Η ΑΘΗΡΩΜΑΤΙΚΗ (ΑΘΗΡΟΣΚΛΗΡΩΤΙΚΗ) ΠΛΑΚΑ ΚΑΙ Η ΦΛΕΓΜΟΝΗ
Ενημερώθηκε στις 26/4/2023
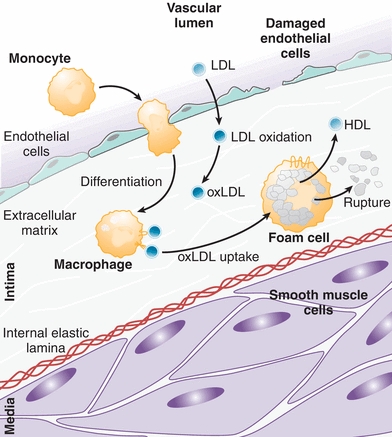
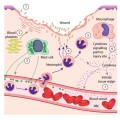
Οι Αθηρωματικές (Αθηροσκληρωτικές) Πλάκες οφείλονται αρχικά σε βλάβη του ενδοθηλίου που δημιουργείται κυρίως από την αυξημένη LDL Χοληστερίνη (και από άλλες Λιποπρωτεΐνες), από Υπέρταση, από Κάπνισμα, από Σ. Διαβήτη, από τη δημιουργία ελευθέρων ριζών Ο2 (ROS) και από άλλους παράγοντες και στη συνέχεια στη φλεγμονή που προκαλεί η είσοδος LDL χοληστερίνης αμέσως κάτω από το ενδοθήλιο και η μετατροπή της τοπικά, σε οξειδωμένη LDL (ox-LDL).
[Ενδοθήλιο είναι το μονό στρώμα των κυττάρων της αρτηρίας που έρχεται σε επαφή με το αίμα και μοιάζει με πλακόστρωτο.
Η οξείδωση της LDL και και άλλων Λιποπρωτεϊνών που περιέχουν αποπρωτεΐνη apo- Β100 γίνεται κυρίως από ελεύθερες ρίζες Οξυγόνου]
[Οι αθηροσκληρωτικές πλάκες δημιουργούνται κυρίως σε σημεία όπως οι διακλαδώσεις και οι καμπύλες των αρτηριών όπου υπάρχει στροβιλώδης ροή, οπότε τα ενδοθηλιακά κύτταρα χάνουν την ευθυγράμμιση τους με αποτέλεσμα να αυξάνεται η δυνατότητα στις απολιποπρωτεΐνες Β 100 να εισχωρούν κάτω από αυτά.
Η βλάβη- δυσλειτουργία των ενδοθηλιακών κυττάρων τα μετατρέπει σε κύτταρα που ευνοούν τη φλεγμονή και τη δημιουργία θρόμβων και ακυρώνουν το ρόλο τους σαν φράγματος, ανάμεσα στο αίμα και στο υπόλοιπο αρτηριακό τοίχωμα]
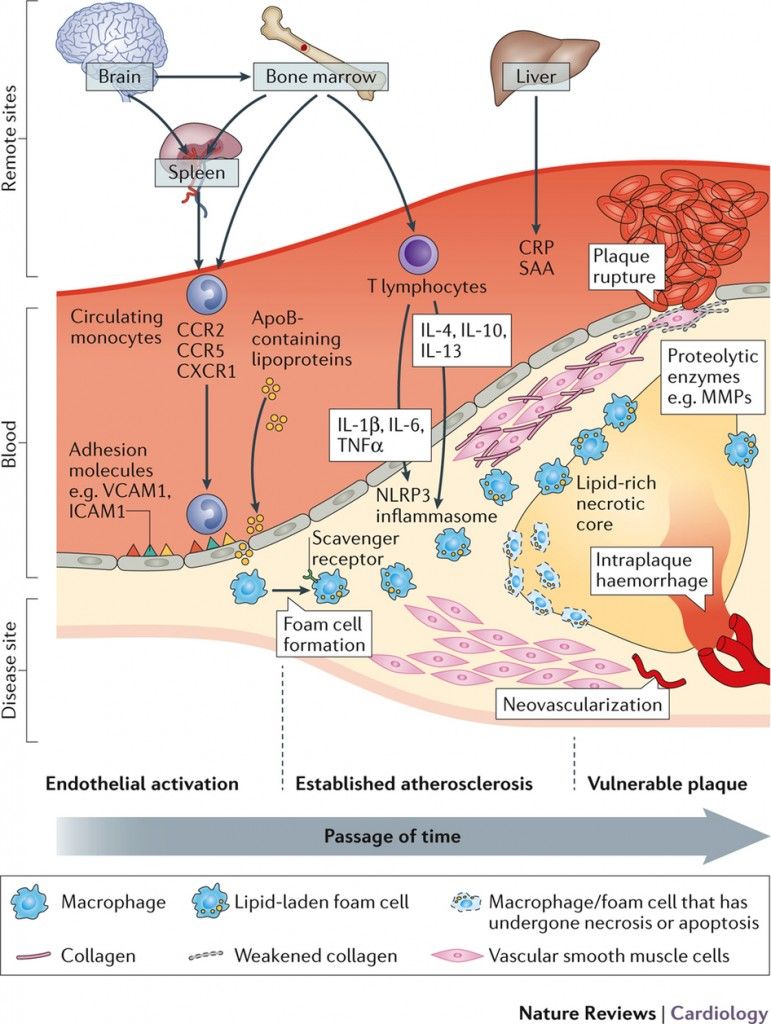
>> Η φλεγμονή ξεκινά με την Ιντερλευκίνη (IL)-1β των Μ1 Μακροφάγων και στην αρχή είναι προστατευτική ώστε να εξουδετερωθεί από αυτά, ο θεωρούμενος “εισβολέας” ox LDL, όμως αργότερα στην πορεία μπορεί να εξελιχθεί σε συνεχή ήπια, χρόνια φλεγμονή του αρτηριακού τοιχώματος, όταν οι μηχανισμοί που την προκαλούν υπερισχύουν των προστατευτικών αντι-αθηρωματικών μηχανισμών. (Δες πιο κάτω)
[Yπ’ όψιν ότι η φλεγμονή επιτείνεται αν υπάρχει παχυσαρκία που προκαλεί ήπια χρόνια φλεγμονή στον οργανισμό μέσω έκκρισης Λιποκυτοκινών (Adipokines) από τον λιπώδη ιστό και από τα λιποκύτταρα γύρω από το αγγείο.]
Η είσοδος της LDL χοληστερίνης και άλλων Λιποπρωτεϊνών που περιέχουν αποπρωτεΐνη apo- Β100 και της Λιποπρωτείνης a (Lp-a), κάτω από το ενδοθήλιο οφείλεται τόσο στην αυξημένη ποσότητα της στο αίμα, όσο και σε βλάβη του ενδοθηλίου των αρτηριών.
Στις Λιποπρωτεΐνες που περιέχουν apo- Β100 και προκαλούν αθηρωμάτωση, συγκαταλέγονται και τα απομεινάρια με χοληστερίνη των VLDL (Τριγλυκερίδια).
[>> Δες και το άρθρο: ΠΟΙΕΣ ΑΘΗΡΩΜΑΤΙΚΕΣ ΠΛΑΚΕΣ ΠΡΟΚΑΛΟΥΝ ΟΞΥ ΕΜΦΡΑΓΜΑ ?]
https://sciendo.com/article/10.2478/jtim-2022-0012
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8954705/
Οι Αθηροσκληρωτικές Πλάκες στενεύουν τον αυλό κυρίως των μεσαίου μεγέθους αρτηριών και προκαλούν τη σταθερή στεφανιαία νόσο, την αποφρακτική αρτηριοπάθεια των κάτω άκρων, στενώσεις σε αρτηρίες του εγκεφάλου και τη στένωση των έσω καρωτίδων.
Από την ρήξη τους προκαλούνται τα οξέα Καρδιαγγειακά νοσήματα, δηλαδή το οξύ έμφραγμα μυοκαρδίου (STEMI ή NSTEMI), το ισχαιμικό εγκεφαλικό επεισόδιο, ή και o θάνατος από αυτά.
>> Η αυξημένη ποσότητα της LDL χοληστερίνης στο αίμα οφείλεται σε αυξημένη παραγωγή της από το ήπαρ, κληρονομικά και επιπλέον σε αυξημένη κατανάλωση φαγητών με χοληστερίνη, κεκορεσμένα και trans λιπαρά.
>> Πέρα από τις αιτίες που προκαλούν βλάβη του ενδοθηλίου και αναφέρονται πιο πάνω, αυτή δημιουργείται και από άλλες αιτίες όπως μηχανικά ερεθίσματα (π.χ. από στροβιλώδη- τυρβώδη ροή του αίματος κυρίως σε διχασμούς των αρτηριών οπότε τα κύτταρα του ενδοθηλίου χάνουν την ευθυγράμμιση τους), από τις φλεγμονώδεις Κυτταροκίνες, από βιολογικές αιτίες (π.χ. μικρόβια, ιοί), από τα ΡΜ 2,5 (αιωρούμενα μικροσωματίδια) κλπ.
http://circ.ahajournals.org/content/136/7/618.full?ijkey=gXiUq7Nij3Ok87C&keytype=ref
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3040314/
https://www.nature.com/articles/ncomms14361
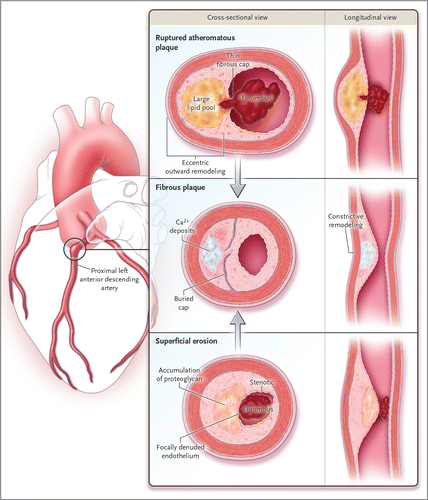
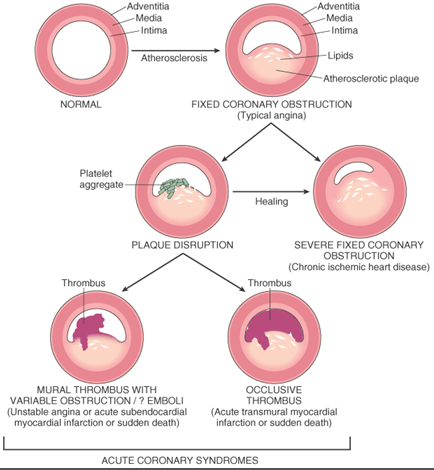
>> Η Αθηροσκληρωτική Πλάκα συνήθως εξελίσσεται σε διάστημα πολλών ετών, μπορεί όμως να εξελιχθεί και σε σύντομο χρονικό διάστημα.
Συνηθέστερα υφίστανται ρήξη οι μαλακές ευάλωτες πλάκες μετρίου μεγέθους, αφού πρώτα μεγαλώσουν απότομα, σε διάστημα μηνών (8-12 ?).
https://www.jacc.org/doi/epdf/10.1016/j.jacc.2021.10.035
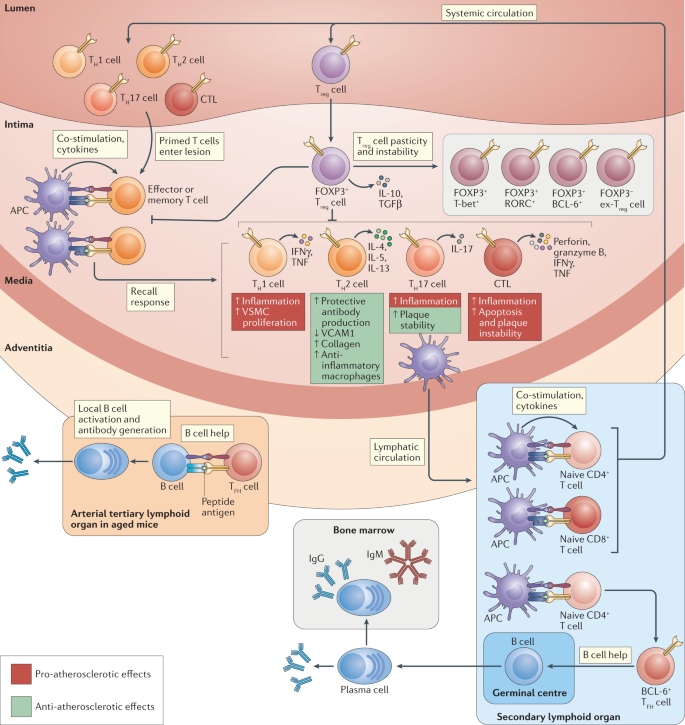
>>> Η Αθηροσκληρωτική Πλάκα δημιουργείται, εξελίσσεται και τελικά “σπάει” (ρήγνυται) από την αλληλεπίδραση ox–LDL, δυσλειτουργικού ενδοθηλίου και μεταβληθέντων λείων μυϊκών ινών από τη μια, και κυττάρων τόσο της εγγενούς άμυνας- ανοσίας (π.χ. μονοκύτταρα, μακροφάγα, δενδριτικά κύτταρα) όσο και της επίκτητης άμυνας (π.χ. Λεμφοκύτταρα Τ h1, Λεμφοκύτταρα Β 2 που παράγουν IgG κλπ.) από την άλλη.
[Αντίθετα τα Λεμφοκύτταρα Τh2 και τα Λεμφοκύτταρα Β1 (παράγουν IgM), αποτρέπουν τη δημιουργία – εξέλιξη της Αθηροσκληρωτικής Πλάκας]
>> Στη δημιουργία της Αθηροσκληρωτικής Πλάκας συμμετέχουν επίσης γερασμένα κύτταρα της αρτηρίας (π.χ. τα ενδοθηλιακά) και οι λείες μυικές ίνες.
>> Η δημιουργία της Αθηροσκληρωτικής Πλάκας ευνοείται επιπλέον από την ύπαρξη μεταλλαγμένων λευκοκυττάρων με διαφοροποιημένη λειτουργικότητα από τα φυσιολογικά (clonal haematopoiesis of indeterminate potential ή CHIP) σε ανθρώπους κυρίως άνω των 65 ετών.
>> Επίσης όταν αλλοιωθεί το μικροβίωμα του εντέρου μας (τρισεκατομύρια μικροοργανισμοί), π.χ. από υπερβολική διατροφή με ζωικές πρωτεΐνες, αυξάνεται η παραγωγή TMAO (trimethylamine-N-oxide) που σχετίζεται με τη δημιουργία της Αθηροσκληρωτικής Πλάκας μέσω φλεγμονής.
[Τα λεμφοκύτταρα Β παράγουν αντισώματα εναντίον “αντιγόνων” όπως η ox–LDL, η απολιποπρωτεΐνη apo- Β100 κλπ. Επίσης τα αυξημένα IgE αντισώματα (που προδιαθέτουν σε αλλεργίες) σχετίζονται με αθηροσκλήρωση.
Πρόσφατες μελέτες δείχνουν ότι συμμετέχουν στη δημιουργία της αθηρωμάτωσης και “διαταραγμένα” γονίδια που δεν οδηγούν σε παραγωγή πρωτεϊνών (noncoding genes), όπως αυτά που δημιουργούν τα miRNAs και τα lncRNAs.
Επίσης διάφορες πρωτεΐνες του αίματος σχετίζονται με την αθηρωμάτωση όπως η CRP, η Ιντερλευκίνη 6, το ΒΝΡ και NT-proBNP, πρωτεΐνες που σχετίζονται με τα ουδετερόφιλα (AMBP, NID1), KIM-1 κλπ.]
>>>> Το μέγεθος των Αθηροσκληρωτικών Πλακών αυξάνεται, αν ο μηχανισμός της αντίστροφης μεταφοράς χοληστερίνης υπολειτουργεί ή αν συνεχίζεται η είσοδος LDL χοληστερίνης ή/και αν συνεχίζεται η βλάβη του ενδοθηλίου ή αν επιμένει- αυτοδιαιωνίζεται η φλεγμονή από τα αμυντικά κύτταρα του οργανισμού.
* Οι αθηροσκληρωτικές πλάκες αυξάνονται σε μέγεθος μέσω επαναλαμβανόμενων κύκλων νεκρώσεως των μακροφάγων και των αφρωδών κυττάρων.
# Οι πιθανές εξελίξεις των αθηρωματικών πλακών είναι:
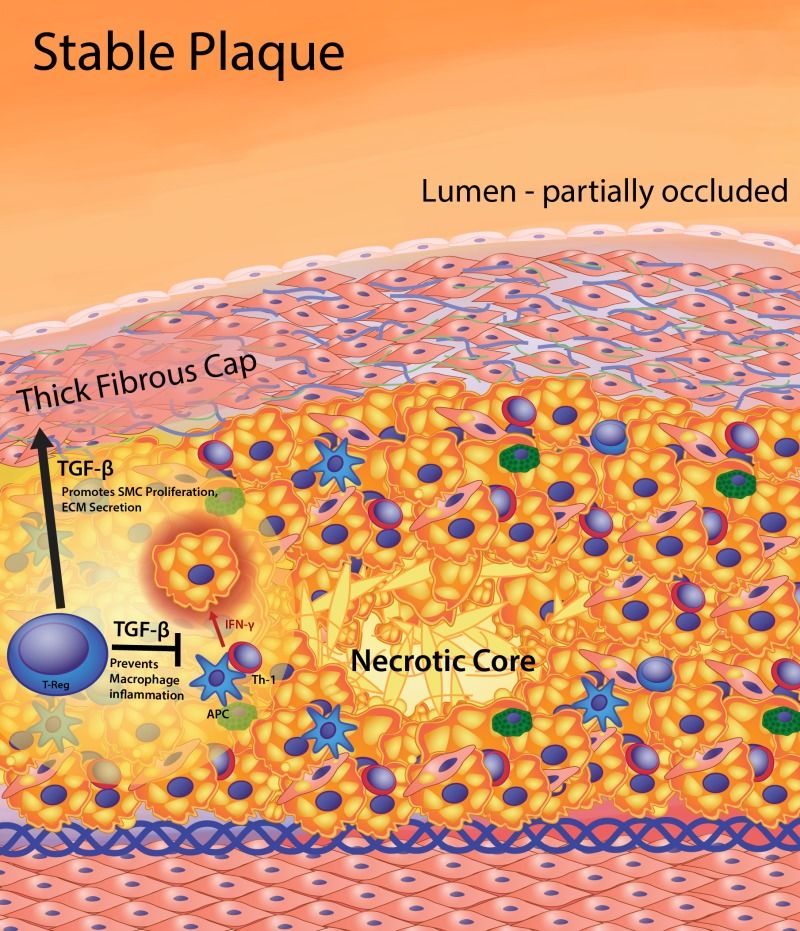
1) είτε να μετατραπούν σε σκληρές πλάκες (που στενεύουν τον αυλό του αγγείου και μειώνουν την ροή του αίματος λίγο ή πολύ) με λίγη χοληστερίνη, πολλά λεία μυϊκά κύτταρα (και άλλα στοιχεία συνδετικού ιστού) και Ασβέστιο.
Λόγω της φλεγμονής, Λείες μυϊκές ίνες από τον μέσο χιτώνα του αγγείου μετατρέπονται σε κύτταρα που δρουν σαν οστικά κύτταρα και εναποθέτουν Ασβέστιο στην αθηρωματική πλάκα.
Το Ασβέστιο αρχίζει να εναποτίθεται στην αθηρωματική πλάκα, στην προσπάθεια του οργανισμού για “θεραπεία” της και όταν αυτό αυξηθεί σε σημαντικό βαθμό (Macro-Calcification) μετριέται από το score Ασβεστίου των στεφανιαίων αρτηριών (CAC).
> Οι Σκληρές πλάκες μπορεί να προέρχονται και από επαναλαμβανόμενους κύκλους ρήξης μαλακής πλάκας (ή διάβρωσης της ?) με ή χωρίς συμπτώματα και επούλωσης της.
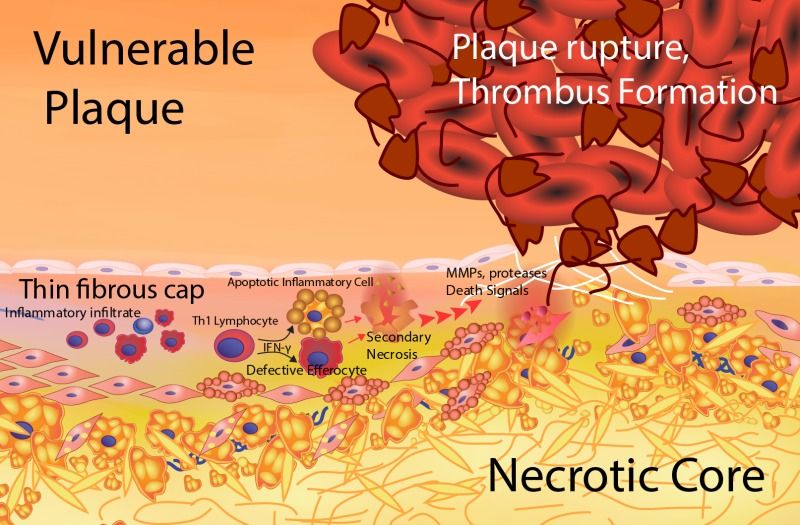
2) είτε να μετατραπούν σε μαλακές πλάκες (ευάλωτες) με πολλή χοληστερίνη και λεπτή ινώδη κάψα με λίγα λεία μυϊκά κύτταρα. [Επίσης σ’ αυτές είναι πολύ αυξημένα τα μακροφάγα και τα μικροαγγεία μέσα στο αγγείο (vasa vasorum).]
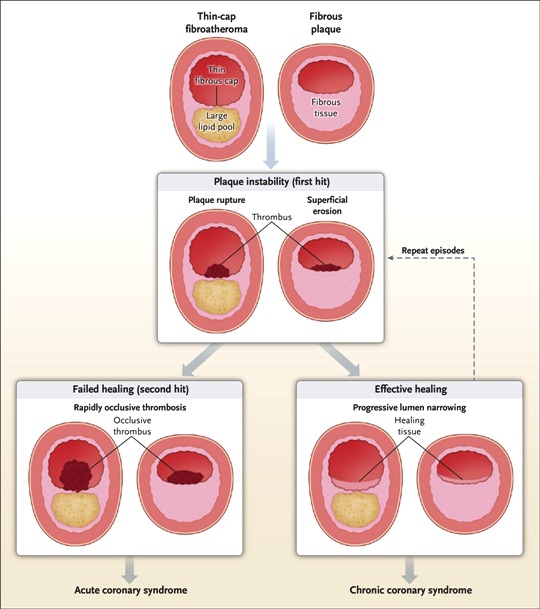
>> Οι μαλακές πλάκες στο μέλλον μπορεί να μετατραπούν σε σκληρές πλάκες ή να ραγούν και να προκαλέσουν έμφραγμα (plaque disruption and impaired healing) ή να ραγούν και να επουλωθούν, χωρίς έμφραγμα.
>> Η ρήξη και η επούλωση χωρίς έμφραγμα, συμβαίνει αν οι μηχανισμοί διάλυσης του θρόμβου υπερισχύσουν των μηχανισμών θρομβογένεσης και αν οι αντιφλεγμονώδεις παράγοντες (π.χ. Μ2 Μακροφάγα), υπερισχύσουν των παραγόντων που προκαλούν φλεγμονή (π.χ. Μ1 Μακροφάγα).
* Η αθηροσκληρωτική πλάκα ασχέτως μεγέθους (ακόμη και < 50%) μπορεί να σπάσει- ραγεί προς τον αυλό της αρτηρίας, αν είναι μαλακή με μεγάλο λιπώδη πυρήνα και λεπτή προστατευτική ινώδη κάψα και αν υπάρχει έντονη φλεγμονή σ’ αυτήν.
https://www.nejm.org/doi/full/10.1056/NEJMra2000317
ΣΥΝΟΠΤΙΚΑ ΣΤΗ ΔΗΜΙΟΥΡΓΙΑ, ΕΞΕΛΙΞΗ ΚΑΙ ΡΗΞΗ ΤΩΝ ΑΘΗΡΟΣΚΛΗΡΩΤΙΚΩΝ ΠΛΑΚΩΝ ΣΥΜΜΕΤΕΧΟΥΝ:
* Η αυξημένη LDL χοληστερίνη [και άλλες Λιποπρωτεϊνες που περιέχουν αποπρωτεΐνη apo- Β100 και της Λιποπρωτείνης a (Lp-a)], η είσοδος της κάτω από το ενδοθήλιο και η μετατροπή της σε οx–LDL.
* Η είσοδος των Υπολειμμάτων (Remnants) των VLDL και των Χυλομικρών κάτω από ενδοθήλιο χωρίς να οξειδωθούν και επίσης των ελεύθερων λιπαρών οξέων (FFA).
* Η βλάβη του ενδοθηλίου από στροβιλώδη ροή και από τους άλλους παράγοντες κινδύνου (Κάπνισμα, Υπέρταση, Σ. Διαβήτης κ.λ.π.).
* Μεταβληθείσες λείες μυϊκές ίνες σε κύτταρα που μοιάζουν με μακροφάγα με μειωμένη όμως απόδοση- λειτουργικότητα.
* Κύτταρα της εγγενούς ανοσίας (όπως μονοκύτταρα, μακροφάγα) και της επίκτητης ανοσίας (όπως τα λεμφοκύτταρα Τh1).
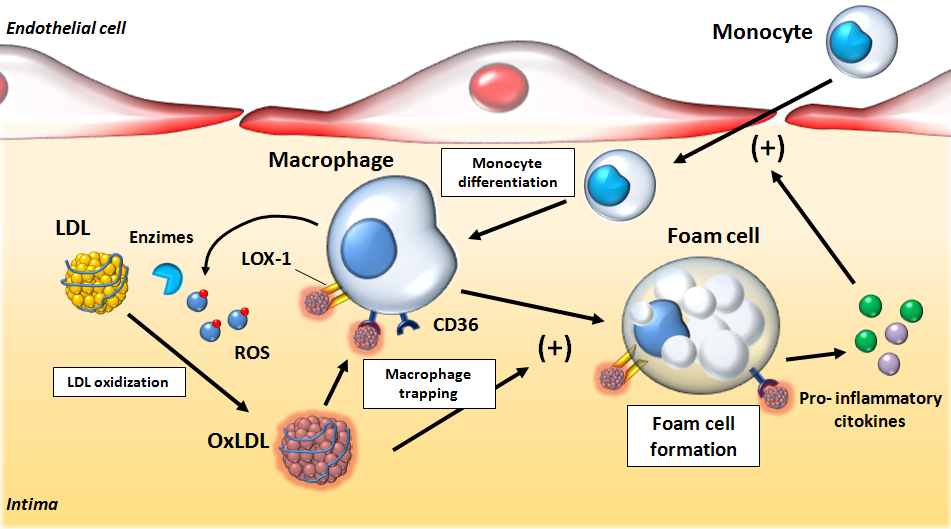
# Η LDL χοληστερίνη που εισχωρεί στο τοίχωμα της αρτηρίας μετατρέπεται σε οξειδωμένη LDL- ox-LDL, (λόγω αύξησης των ελευθέρων ριζών ROS ή από μειωμένη αποτελεσματικότητα των αντι-οξειδωτικών μηχανισμών).
# Η οx–LDL θεωρείται από τον οργανισμό βλαβερή ουσία που πρέπει να καταπολεμηθεί- εξουδετερωθεί.
# Έτσι επιστρατεύονται μονοκύτταρα από το αίμα που μετατρέπονται σε Μακροφάγα Μ1 κύτταρα για να εξουδετερώσουν την ox-LDL “τρώγοντας” την. Όταν τα Μακροφάγα φορτωθούν με πολύ Χοληστερίνη μετατρέπονται σε αφρώδη κύτταρα.
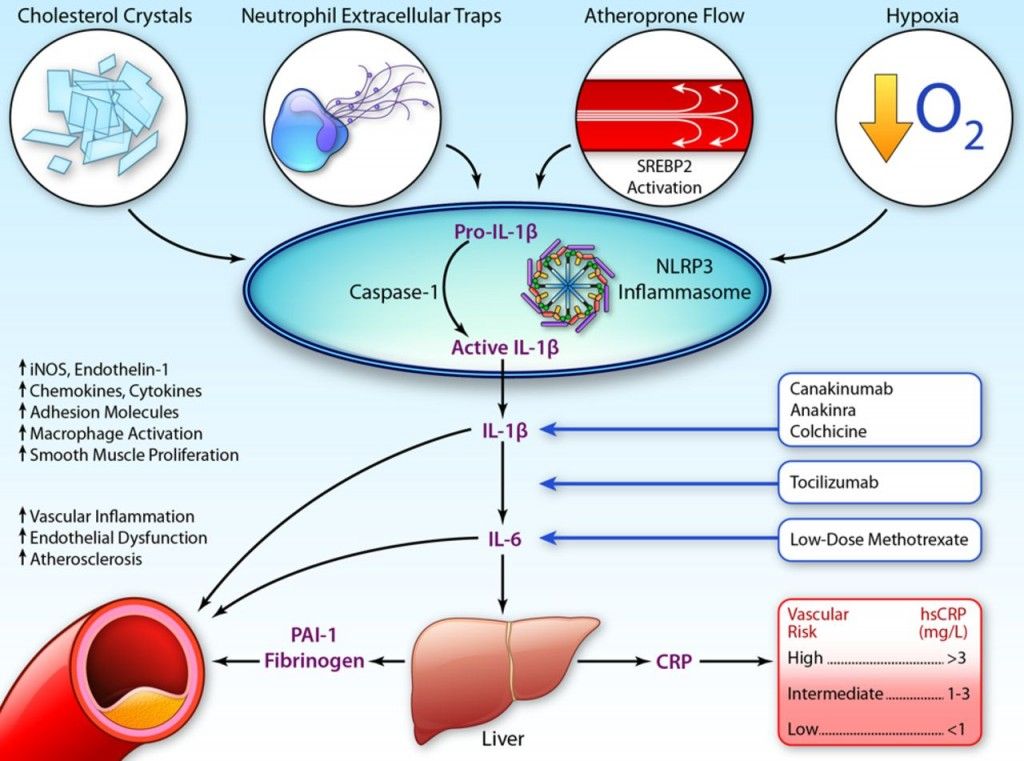
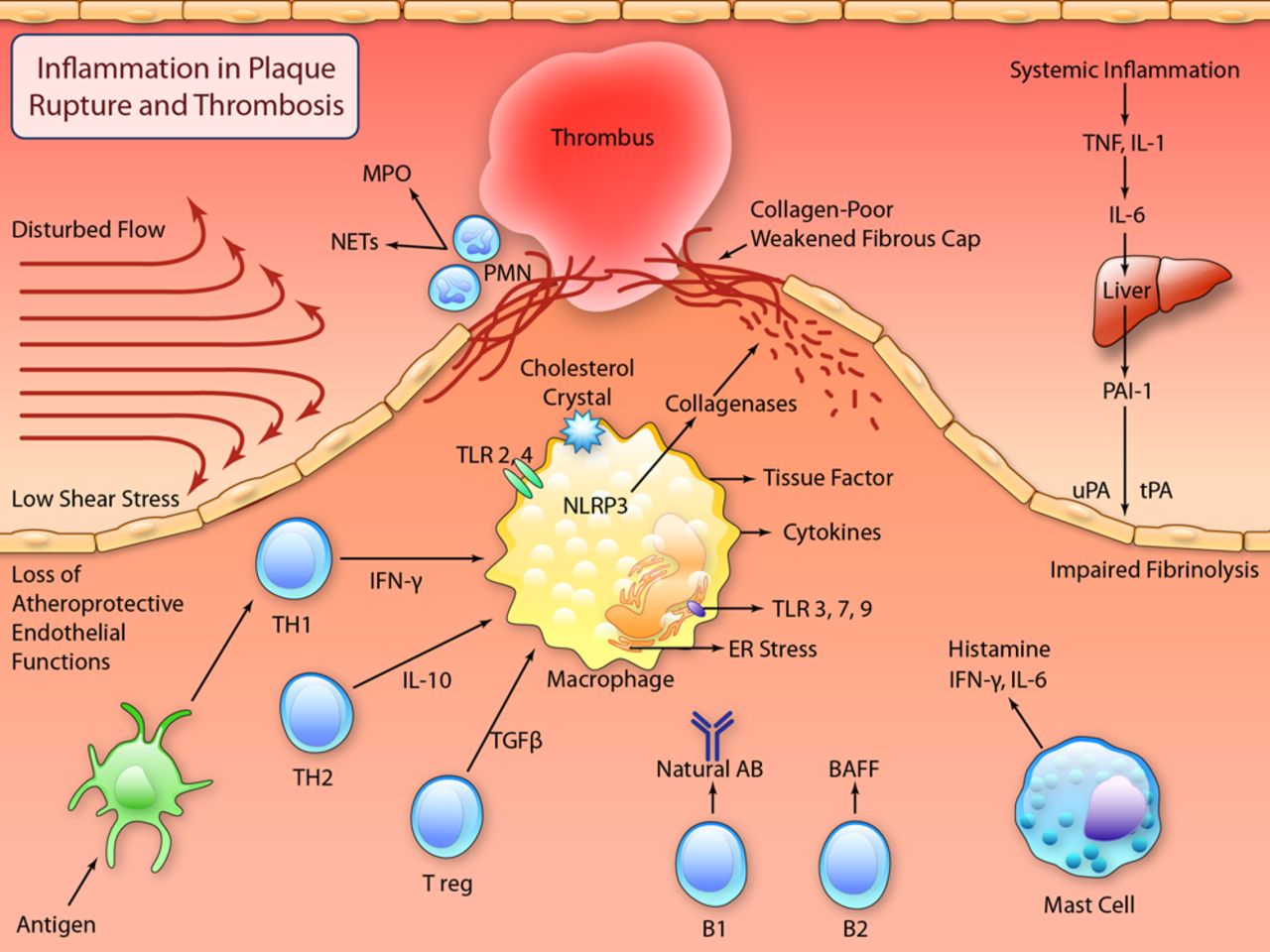
# Η ox-LDL και οι κρύσταλλοι Χοληστερίνης που έχουν φαγωθεί από τα Μακροφάγα προκαλούν την παραγωγή Ιντελευκίνης IL-1β και IL-18 από αυτά (μέσω του NLRP3 inflammasome).
[Οι εντολές και οι αλληλεπιδράσεις μεταξύ όλων των κυττάρων της φλεγμονής και της οx–LDL γίνονται από ουσίες που λέγονται Κυτοκίνες με πιο σπουδαία την αρχική IL-1β]
>> Το μέγεθος των Αθηροσκληρωτικών Πλακών αυξάνεται, αν ο μηχανισμός της αντίστροφης μεταφοράς χοληστερίνης υπολειτουργεί ή συνεχίζεται η είσοδος LDL χοληστερίνης ή/και συνεχίζεται η βλάβη του ενδοθηλίου ή επιμένει- αυτοδιαιωνίζεται η φλεγμονή από τα αμυντικά κύτταρα του οργανισμού.
>> Οι αθηροσκληρωτικές πλάκες αυξάνονται σε μέγεθος μέσω επαναλαμβανόμενων κύκλων νεκρώσεως των μακροφάγων και των αφρωδών κυττάρων.
>> Η αθηροσκληρωτική πλάκα ασχέτως μεγέθους μπορεί να σπάσει- ραγεί προς τον αυλό της αρτηρίας, αν είναι μαλακή με μεγάλο λιπώδη πυρήνα και λεπτή προστατευτική ινώδη κάψα και αν υπάρχει έντονη φλεγμονή σ’ αυτήν.
>> Ο οργανισμός δημιουργεί θρόμβο πάνω στην πλάκα για να σταματήσει την αιμορραγία, όμως έτσι σταματά τη ροή του αίματος, οπότε μπορεί να συμβεί οξύ έμφραγμα του μυοκαρδίου (αν η πλάκα βρίσκεται σε στεφανιαία αρτηρία) ή ισχαιμικό εγκεφαλικό επεισόδιο (αν η πλάκα βρίσκεται σε αρτηρία του εγκεφάλου ή στην έσω καρωτίδα).
>> Η σημερινή θεραπεία της Στεφανιαίας Νόσου, περιλαμβάνει τις Στατίνες (που μειώνουν την LDL χοληστερίνη), την Ασπιρίνη (που μειώνει τη δημιουργία θρόμβων σε ραγείσες πλάκες δρώντας αντιαιμοπεταλιακά) και τους β-αναστολείς (που μειώνουν τις ανάγκες του μυοκαρδίου σε οξυγόνο).
* Τελικά φαίνεται όμως ότι θα αρχίσουμε σύντομα να χρησιμοποιούμε και ορισμένα αντιφλεγμονώδη φάρμακα, ιδίως σε αυτούς που παρ’ όλη την μεγάλη μείωση της LDL χοληστερίνης στο αίμα (π.χ. 40-50 mg/dL) συνεχίζουν να εξελίσσουν αθηρωματικές πλάκες (ή/και αν έχουν αυξημένη CRP).
https://www.nature.com/articles/s41573-021-00198-1
ΤΟ ΕΜΦΡΑΓΜΑ ΔΕΝ ΜΠΟΡΕΙ ΝΑ ΠΡΟΒΛΕΦΘΕΙ ΠΑΝΤΑ
Ορισμένα εμφράγματα είναι αδύνατον να προβλεφθούν.
Δυστυχώς οι εξετάσεις που βρίσκουν ισχαιμία δεν μπορούν να προβλέψουν το έμφραγμα τύπου 1, που συμβαίνει από ρήξη ευάλωτης πλάκας που δεν προκαλεί ισχαιμία ή από διάβρωση ενδοθηλίου πλάκας που δεν προκαλεί ισχαιμία.
(Περίπου το 30% των εμφραγμάτων τύπου Ι συμβαίνει από διάβρωση του ενδοθηλίου της πλάκας).
Επιπλέον πολλά εμφράγματα γίνονται και από ελάχιστη στένωση κάτω από 30%, κυρίως λόγω σπασμού της στεφανιαίας αρτηρίας ( έμφραγμα τύπου 2).
Η ΔΗΜΙΟΥΡΓΙΑ ΤΟΥ ΕΜΦΡΑΓΜΑΤΟΣ ΤΥΠΟΥ 1
Πολλές περιπτώσεις οξέων στεφανιαίων συνδρόμων, δυστυχώς, συμβαίνουν σε πλάκες που δεν προκαλούν σημαντική στένωση, συνεπώς δεν μπορεί να ανιχνευθούν από εξετάσεις που βρίσκουν ισχαιμία.
# Οι μαλακές πλάκες ασχέτως μεγέθους (δηλαδή και κάτω από το 50% της διαμέτρου του αυλού) μπορεί να υποστούν ρήξη (ιδίως αν υπάρχει έντονη φλεγμονή σ’ αυτές), οπότε αιμορραγούν προς τον αυλό της αρτηρίας.
Ο οργανισμός δημιουργεί θρόμβο πάνω στην πλάκα για να σταματήσει την αιμορραγία. Αν ο θρόμβος αποφράξει τελείως τον αυλό της αρτηρίας σταματά τη ροή του αίματος, οπότε μπορεί να συμβεί οξύ έμφραγμα του μυοκαρδίου (αν η πλάκα βρίσκεται σε στεφανιαία αρτηρία) ή ισχαιμικό εγκεφαλικό επεισόδιο (αν η πλάκα βρίσκεται σε αρτηρία του εγκεφάλου ή στην έσω καρωτίδα).
# Αν ο οργανισμός καταφέρει να διαλύσει πλήρως το θρόμβο σε λιγότερο από μισή ώρα τα κύτταρα που αρδεύονταν από την αρτηρία επιβιώνουν και επανέρχονται στο φυσιολογικό.
>> Υπ’ όψιν ότι η πλειοψηφία των ρήξεων των αθηρωματικών πλακών δεν προκαλεί κλινικά συμπτώματα και επουλώνονται σιωπηλά.
# Αν καταφέρει να προκαλέσει κερματισμό του και τα μικρά κομμάτια του θρόμβου αποφράξουν μικρά αρτηρίδια δημιουργείται το έμφραγμα NSTEMI μόνο στο εσωτερικό 1/3 του τοιχώματος της αριστερής κοιλίας.
# Αν ο θρόμβος δεν διαλυθεί, τα κύτταρα που αρδεύονταν από την συγκεκριμένη αρτηρία νεκρώνονται λόγω του ότι δεν παίρνουν Οξυγόνο και δημιουργείται το έμφρακτο (= νέκρωση κυττάρων) του μυοκαρδίου (έμφραγμα STEMI σε όλο το πάχος του τοιχώματος).
>> Η σημερινή θεραπεία της Στεφανιαίας Νόσου, περιλαμβάνει τις Στατίνες (που μειώνουν την LDL χοληστερίνη), την Ασπιρίνη (που μειώνει τη δημιουργία θρόμβων σε ραγείσες πλάκες δρώντας αντιαιμοπεταλιακά) και τους β-αναστολείς (που μειώνουν τις ανάγκες του μυοκαρδίου σε οξυγόνο).
* Τελικά φαίνεται όμως ότι θα αρχίσουμε σύντομα να χρησιμοποιούμε και ορισμένα αντιφλεγμονώδη φάρμακα, ιδίως σε αυτούς που παρ’ όλη την μεγάλη μείωση της LDL χοληστερίνης στο αίμα (π.χ. 40-50 mg/dL) συνεχίζουν να εξελίσσουν αθηρωματικές πλάκες (ή/και αν έχουν αυξημένη CRP).
https://www.nature.com/articles/s41573-021-00198-1
ΕΚΤΕΝΕΣΤΕΡΑ
Στη δημιουργία, εξέλιξη και ρήξη των Αθηροσκληρωτικών Πλακών συμμετέχουν:
* Η αυξημένη LDL χοληστερίνη, η είσοδος της κάτω από το ενδοθήλιο και η μετατροπή της σε οx–LDL.
* Η είσοδος των Υπολειμμάτων (Remnants) των VLDL και των Χυλομικρών κάτω από ενδοθήλιο χωρίς να οξειδωθούν και επίσης των ελεύθερων λιπαρών οξέων (FFA).
* Η βλάβη του ενδοθηλίου από στροβιλώδη ροή και από τους άλλους παράγοντες κινδύνου (Κάπνισμα, Υπέρταση, Σ. Διαβήτης κ.λ.π.).
* Μεταβληθείσες λείες μυϊκές ίνες σε κύτταρα που μοιάζουν με μακροφάγα και παράγουν εξωκυττάρια ουσία που συμμετέχει στη δημιουργία της ινώδους κάψας.
* Κύτταρα της εγγενούς ανοσίας (όπως μονοκύτταρα, μακροφάγα) και της επίκτητης ανοσίας (όπως τα λεμφοκύτταρα Τh1).
ΠΩΣ Η ΑΥΞΗΜΕΝΗ LDL ΧΟΛΗΣΤΕΡΙΝΗ ΠΡΟΚΑΛΕΙ ΑΘΗΡΩΜΑΤΙΚΕΣ ΠΛΑΚΕΣ
# Η LDL χοληστερίνη που εισχωρεί στο τοίχωμα της αρτηρίας μετατρέπεται σε οξειδωμένη LDL, λόγω αύξησης των ελευθέρων ριζών ROS ή από μειωμένη αποτελεσματικότητα των αντι-οξειδωτικών μηχανισμών.
# Η οx–LDL θεωρείται από τον οργανισμό βλαβερή ουσία που πρέπει να καταπολεμηθεί- εξουδετερωθεί.
# Έτσι επιστρατεύονται μονοκύτταρα από το αίμα που μετατρέπονται σε Μακροφάγα Μ1 κύτταρα για να εξουδετερώσουν την ox-LDL “τρώγοντας” την. Όταν τα Μακροφάγα φορτωθούν με πολύ Χοληστερίνη μετατρέπονται σε αφρώδη κύτταρα.
Σε αφρώδη κύτταρα μετατρέπονται επίσης λείες μυικές ίνες και μπορούν να μετατραπούν και τα δενδριτικά κύτταρα.
# Η ox-LDL και οι κρύσταλλοι Χοληστερίνης που έχουν φαγωθεί από τα Μακροφάγα προκαλούν την παραγωγή Ιντελευκίνης IL-1β και IL-18 από αυτά (μέσω του NLRP3 inflammasome).
* Οι εντολές και οι αλληλεπιδράσεις μεταξύ όλων των κυττάρων της φλεγμονής και της οx–LDL γίνονται από ουσίες που λέγονται Κυτοκίνες (Κυτταροκίνες) με πιο σπουδαία την αρχική IL-1β.
ΟΙ ΚΥΤΟΚΙΝΕΣ (ΚΥΤΤΑΡΟΚΙΝΕΣ)
Όλες οι αλληλεπιδράσεις γίνονται με χημικά “σήματα” μεταξύ της οx-LDL, των κυττάρων του ενδοθηλίου, των μονοκυττάρων, των μακροφάγων Μ1, των λείων μυϊκών ινών, των λεμφοκυττάρων Τh1 κ.λ.π.
Τα χημικά “σήματα” είναι στην ουσία μικρά πρωτεϊνικά μόρια που λέγονται φλεγμονώδεις Κυτοκίνες (Cytokines). Η προεξάρχουσα φλεγμονώδης Κυτοκίνη είναι η Ιντερλευκίνη (IL) 1β, που είναι η αρχική φλεγμονώδης ουσία της οξείας και χρόνιας φλεγμονής.
Η IL-1β και άλλες φλεγμονώδεις Κυτοκίνες που προέρχονται από αυτήν (όπως η IL-6) ενεργοποιούν όλα τα κύτταρα που συμμετέχουν στην φλεγμονή.
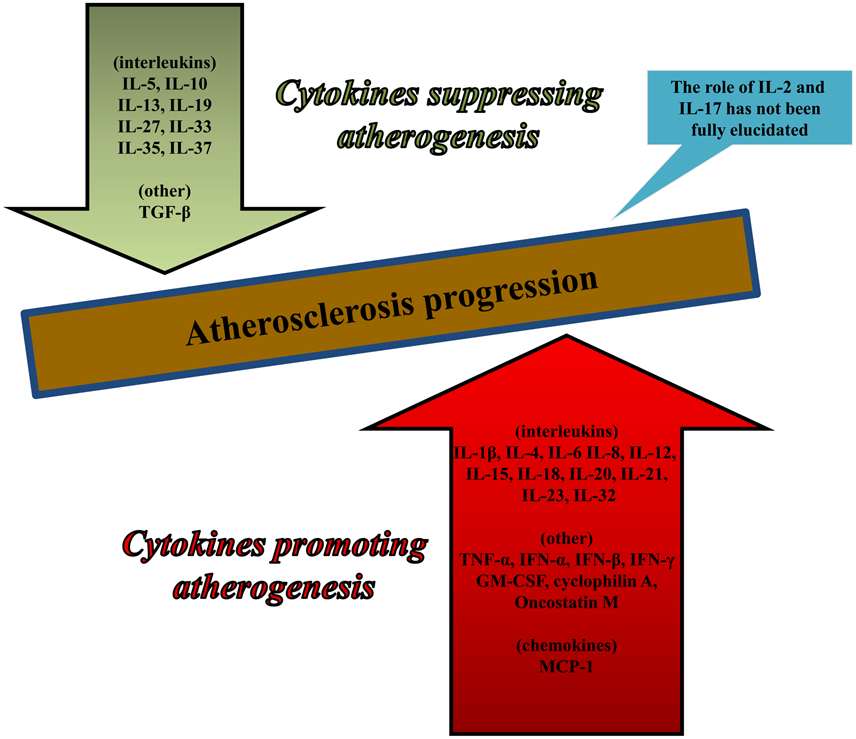
Οι Κυτοκίνες (Cytokines) δίνουν σήμα για διάφορες λειτουργίες του σώματος. Σ’ αυτές υπάγονται οι Χημοκίνες (chemokines) που έλκουν κύτταρα σε ορισμένο σημείο, οι Ιντερλευκίνες (interleukins –IL), οι Ιντερφερόνες, οι TNF (tumour necrosis factors), οι TGF (transforming growth factors) κ.λ.π.
Ορισμένες Κυτοκίνες προκαλούν αθηρογένεση (IL-1, IL-6, IL-18, TNF-α, IFN-γ κ.λ.π. μέσω των μακροφάγων Μ1, λεμφοκυττάρων, λείων μυϊκών ινών, natural killer cells κ.λ.π.) ενώ άλλες την εμποδίζουν, είναι αντι-αθηρογόνες (TGF-β, IL-10, IL-35 IL-37 κ.λ.π. μέσω των λεμφοκυττάρων T-regulatory (Treg) cells κ.λ.π.
Η ΔΗΜΙΟΥΡΓΙΑ ΤΗΣ ΑΘΗΡΟΣΚΛΗΡΩΤΙΚΗΣ ΠΛΑΚΑΣ
(Για όποιον ενδιαφέρεται, το κείμενο με πορτοκαλί χρώμα, έχει περισσότερες λεπτομέρειες)
# Η LDL χοληστερίνη ξεκινά τη ζωή της από το ήπαρ σαν σωματίδια VLDL χοληστερίνης που μετατρέπονται σε σωματίδια ΙDL χοληστερίνης και τελικά σε σωματίδια LDL χοληστερίνης.
# Η αθηροσκληρωτική πλάκα δημιουργείται από την φλεγμονή που προκαλεί η είσοδος LDL χοληστερίνης κάτω από το ενδοθήλιο και η μετατροπή- οξείδωση της, τοπικά σε ox-LDL.
# Επίσης η είσοδος των Υπολειμμάτων (Remnants) των VLDL και των Χυλομικρών κάτω από ενδοθήλιο συμμετέχει στη δημιουργία της αθηροσκληρωτικής πλάκας. Αυτά εξουδετερώνωνται (όπως και η ox-LDL) από τα Μακροφάγα κύτταρα Μ1 (με φαγοκύτωση) χωρίς να χρειάζεται να οξειδωθούν.
* Επιπλέον στη δημιουργία της αθηροσκληρωτικής πλάκας συμμετέχουν και τα ελεύθερα λιπαρά οξέα (FFA) που δημιουργούνται από τη δράση της LPL.
http://www.ajconline.org/article/S0002-9149(16)30484-2/fulltext
# Η οξείδωση της LDL συμβαίνει είτε λόγω αύξησης των ελευθέρων ριζών και ιδίως όσων περιέχουν οξυγόνο (Ο2) (αυτές λέγονται ROS– Reactive oxygen species) είτε από μειωμένη αποτελεσματικότητα των αντι-οξειδωτικών μηχανισμών του οργανισμού (π.χ. βιταμινών Α, C, Ε και αντιοξειδωτικών ενζύμων όπως της Glutathione peroxidase).
Οι ελεύθερες ρίζες έχουν μονό αριθμό ηλεκτρονίων αντί ζυγό και δημιουργούνται φυσιολογικά στο σώμα, αλλά σε καταστάσεις stress (π.χ. φλεγμονή, ιονίζουσα ακτινοβολία) αυξάνονται παθολογικά και υπέρμετρα, οπότε προκαλούν βλάβη στο κύτταρο (οξειδωτικό stress).
Οι ROS επειδή χρειάζονται και άλλο ηλεκτρόνιο, για να έχουν ζυγό αριθμό, το παίρνουν από τις μεμβράνες των κυττάρων ή τις πρωτεΐνες ή το DNA προκαλώντας βλάβη σ’ αυτά.
# Η οx–LDL θεωρείται από τον οργανισμό βλαβερή ουσία που πρέπει να καταπολεμηθεί- εξουδετερωθεί.
# Η φλεγμονή στην αρχή είναι προστατευτική ώστε να εξουδετερωθεί από τα μακροφάγα, ο “εισβολέας” ox LDL, όμως αργότερα στην πορεία μπορεί να εξελιχθεί σε συνεχή- χρόνια φλεγμονή.
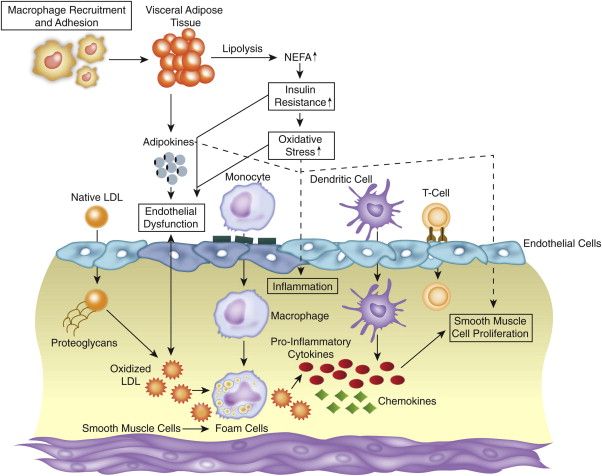
Yπ’ όψιν ότι η φλεγμονή επιτείνεται αν υπάρχει παχυσαρκία που προκαλεί ήπια χρόνια φλεγμονή στον οργανισμό μέσω έκκρισης Λιποκυτοκινών (Adipokines) από τον λιπώδη ιστό και από τα λιποκύτταρα γύρω από το αγγείο.
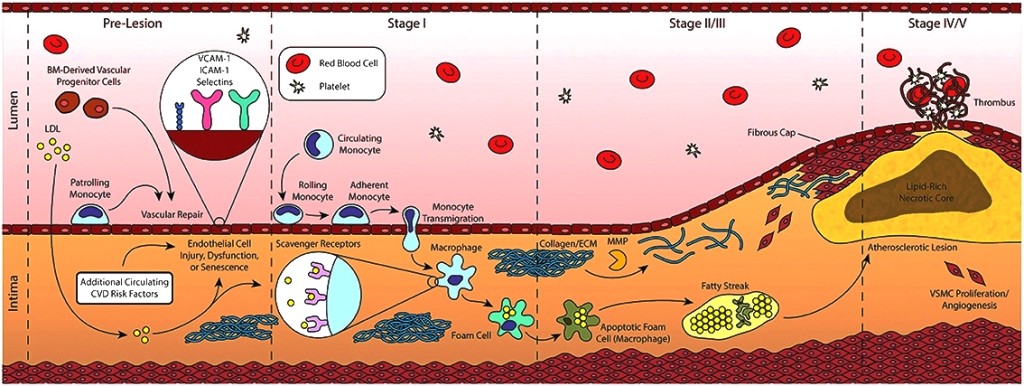
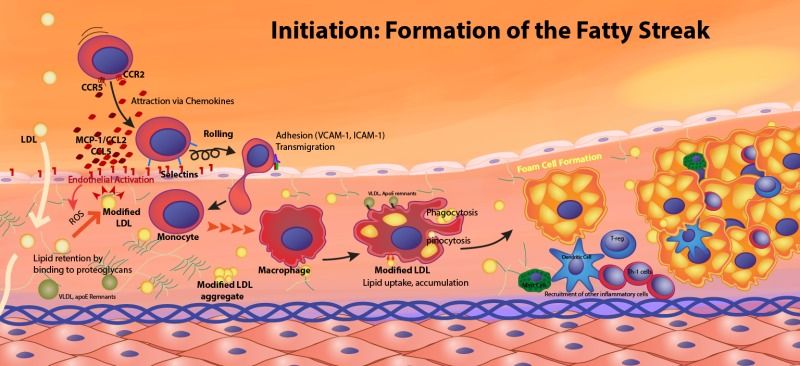
# Έτσι επιστρατεύονται μονοκύτταρα από το αίμα που μετατρέπονται σε Μακροφάγα (Μ1) κύτταρα για να εξουδετερώσουν την ox-LDL “τρώγοντας” την. Η ox-LDL που φαγοκυτώθηκε από τα Μακροφάγα μετατρέπεται σε κρυστάλλους χοληστερίνης.
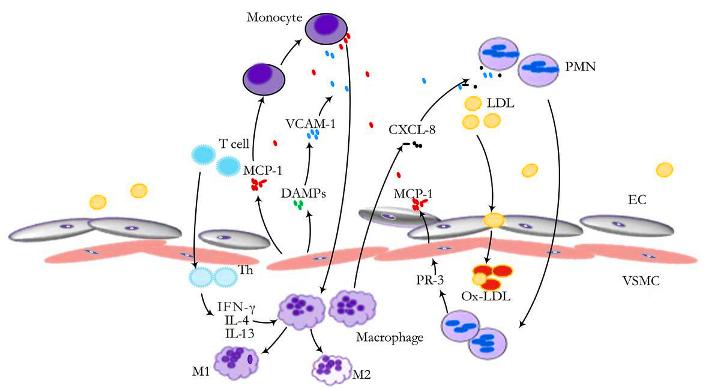
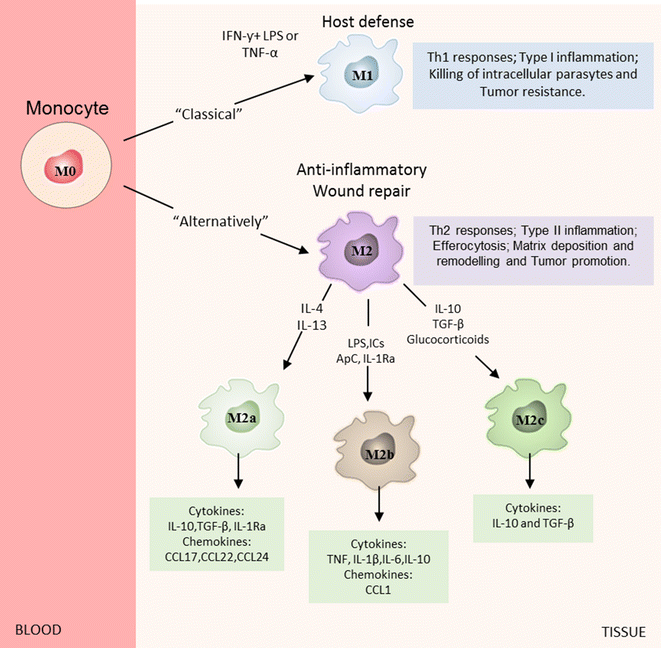
Τα Μακροφάγα διαμορφώνονται ανάλογα με τις κυτοκίνες που υπάρχουν τοπικά στα “βλαβερά”- αθηρογόνα Μ1 και στα εναντίον της φλεγμονής (αντι-αθηρογόνα) Μ2.
Τα μακροφάγα Μ1 δημιουργούνται από τη δράση της IL-1β και της IFN-γ και παράγουν την IL-6, τον TNFα και ROS.
Τα Μ2 δημιουργούνται από αντι-φλεγμονώδεις κυτοκίνες IL-4 και IL-13 και παράγουν τις IL-10 και TGF-β (transforming growth factor-b). Η αποστολή τους είναι η επιδιόρθωση και διάλυση της φλεγμονής.
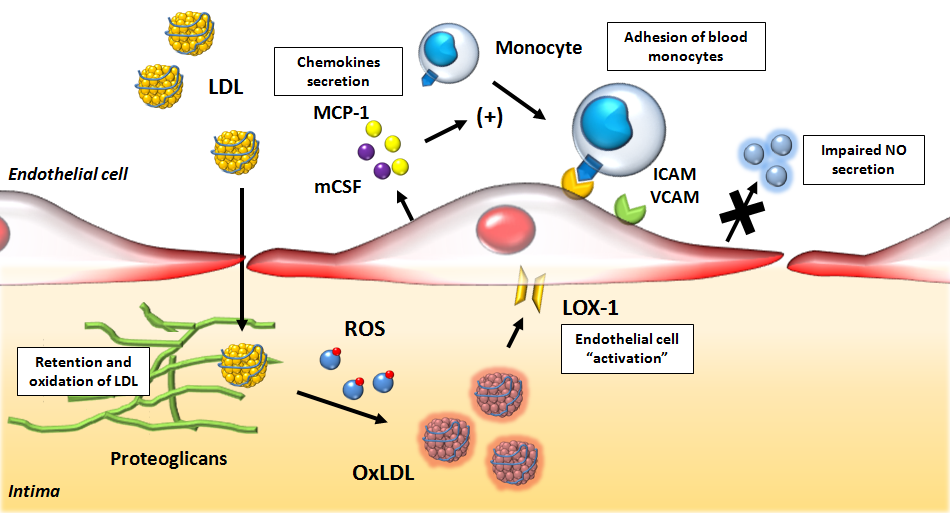
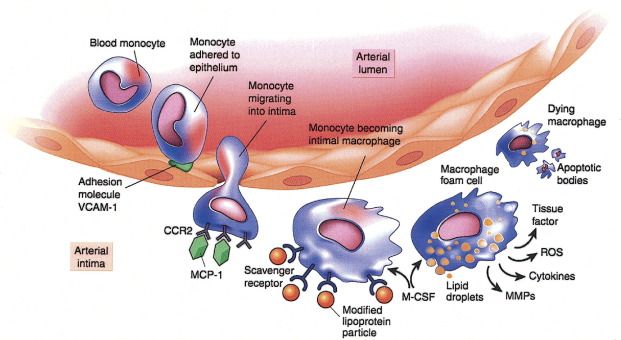
Τα μονοκύτταρα που επιστρατεύονται προέρχονται από τον μυελό των οστών. Αυτά αρχικά έλκονται στο σημείο της “βλάβης”, μέσω της Κυτοκίνης CCL2 ή MCP-1 (monocyte chemoattractant protein) και της IL 8.
Τα μονοκύτταρα στη συνέχεια ενώνονται με τα ενδοθηλιακά κύτταρα, μέσω των μορίων ICAM-1 (inter-cellular adhesion molecule-1) και VCAM-1 (vascular-cell adhesion molecule-1) και αργότερα εισχωρούν κάτω από αυτά.
Όταν τα μονοκύτταρα εισχωρήσουν κάτω από το ενδοθήλιο μετατρέπονται από τις κυτοκίνες M-CSF (macrophage colony stimulating factor), IL-1β (Ιντερλευκίνη 1β) και IFN-γ (Ιντερφερόνη-γ) σε φαγοκύτταρα Μ1 για να εξουδετερώσουν την ox-LDL “τρώγοντας” την, μέσω των υποδοχέων-καθαριστών (scavenger receptors) τους (SR-AI, CD36, LOX-1 κλπ.).
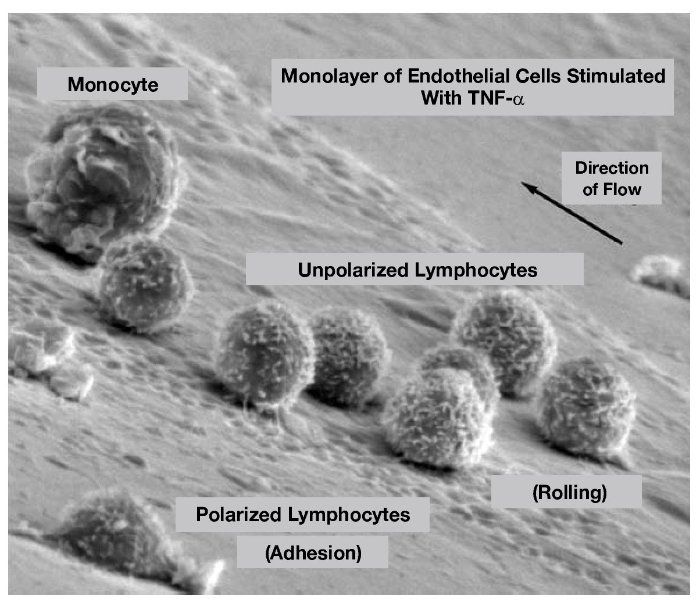
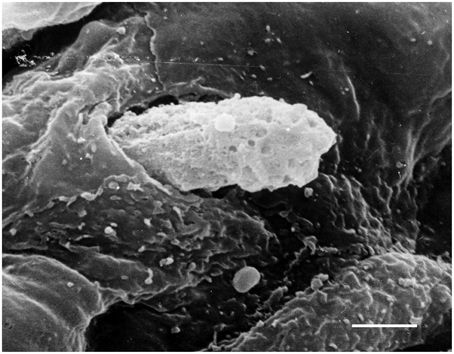
Πάνω, 2 εικόνες από ηλεκτρονικό μικροσκόπιο.
Η πάνω εικόνα δείχνει ένα μονοκύτταρο και πολλά λεμφοκύτταρα που έχουν συλληφθεί κατά την κύλιση τους πάνω στα ενδοθηλιακά κύτταρα. Ένα από αυτά έχει αλλάξει το σχήμα του από σφαιρικό γιατί έχει συνδεθεί στέρεα με το ενδοθήλιο.
Η κάτω εικόνα δείχνει λευκοκύτταρο που διεισδύει κάτω από το ενδοθήλιο.
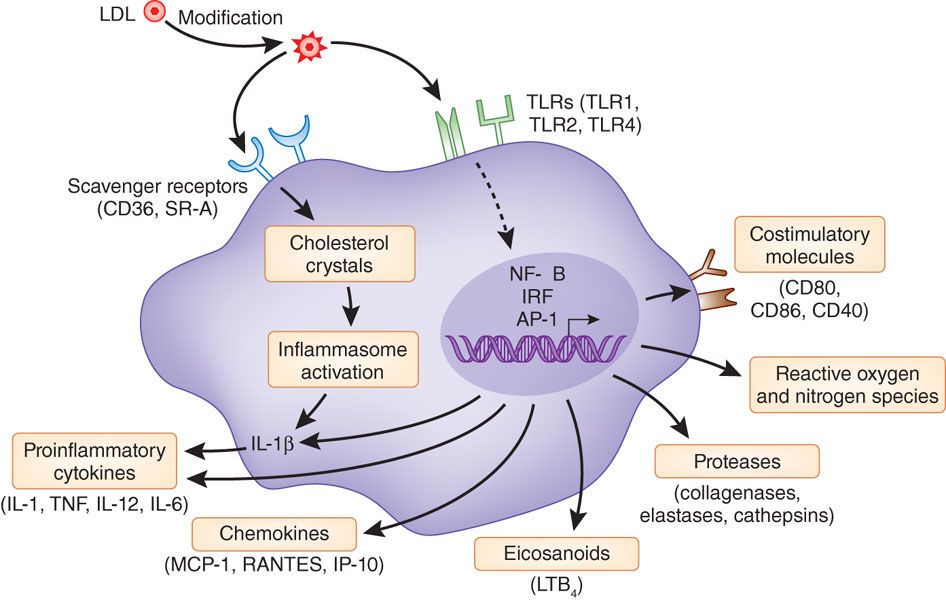
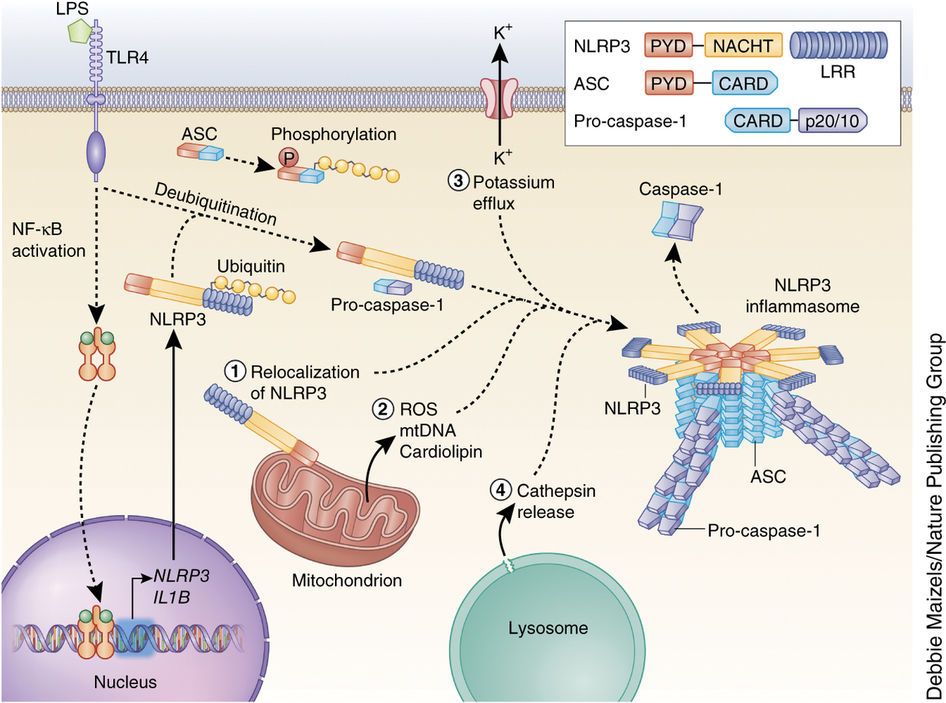
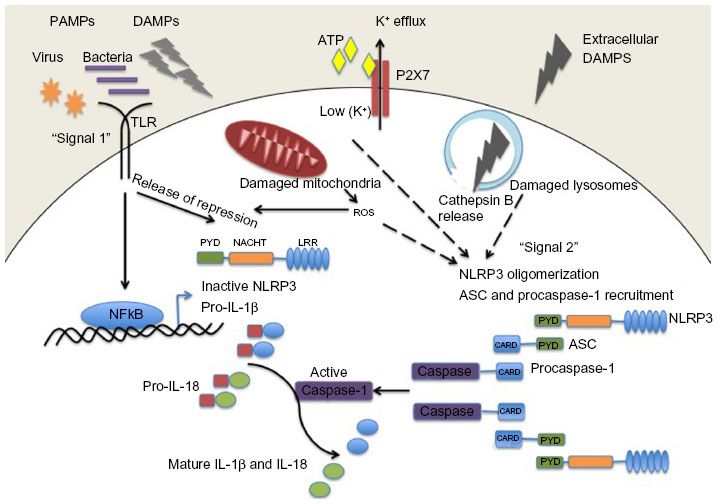
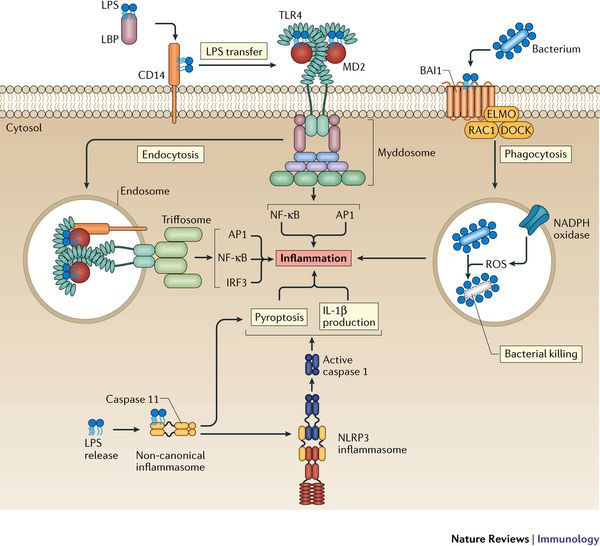
# Η ox-LDL και οι κρύσταλλοι Χοληστερίνης (είτε εξωγενείς είτε ενδογενείς που προήλθαν από φαγοκύτωση της ox-LDL) δρουν στα Μακροφάγα και μέσω του NLRP3 inflammasome, τελικά παράγουν την Κυτοκίνη- Ιντελευκίνη IL-1β και την IL-18.
Όταν υπάρξουν φλεγμονώδεις αιτίες- διεγέρσεις (π.χ. από μικρόβια, από κρυστάλλους χοληστερίνης, από ιούς, από ουσίες από νεκρά κύτταρα, από μείωση του τοπικού οξυγόνου), παράγεται η προ-IL-1β. Αυτή ακολούθως μετατρέπεται στην Κυτοκίνη IL-1β μέσω της caspase-1 που παράγεται από το NLRP3 inflammasome.
Όποτε εμφανιστούν ορισμένα προκαθορισμένα μόρια (PAMPs- Pathogen Associated Molecular Patterns) από μικρόβια ή (DAMPs- Danger Pathogen Associated Molecular Patterns) μετά από βλάβη κυττάρων, υπάρχουν ειδικοί υποδοχείς που τα αναγνωρίζουν σαν επιβλαβή.
Αυτοί λέγονται PRRs (Pattern Recognition Receptors) και βρίσκονται στην μεμβράνη των μακροφάγων κυρίως κυττάρων (π.χ. Τoll-like Receptors, C-type lectin receptors) ή στο εσωτερικό τους (π.χ. Nod-like receptors- NLRs).
Η ox-LDL δρα στους υποδοχείς των Μακροφάγων, Τoll-like Receptors και μέσω αυτών ενεργοποιείται ο ΝF κB (nuclear factor κB) που διεγείρει το DNA του πυρήνα τους και οδηγεί στον σχηματισμό προ-κυτοκινών pro–IL-1β και pro–IL-18 και επιπλέον τη βάση ενός αρχικού- μη ενεργού NLRP3 inflammasome (μεγάλο πολύπλοκο πρωτεϊνικό σύμπλεγμα της εγγενούς ανοσίας).
Στη συνέχεια οι κρύσταλλοι χοληστερίνης (είτε εξωγενείς είτε ενδογενείς που προήλθαν από φαγοκύτωση της ox-LDL, μέσω των CD36 υποδοχέων), οδηγούν μέσω των nucleotide-binding domain-like receptor (NLRs), σε συναρμολόγηση- ενεργοποίηση του NLRP3 inflammasome που συνδέεται με ASC and procaspase-1.
Ακολούθως από το NLRP3 inflammasome παράγεται Caspase 1 που μετατρέπει τις pro-IL-1β and pro-IL-18 στις ενεργές μορφές τους IL-1β και IL-18.
# Η IL-1β που είναι η αρχική και η σπουδαιότερη Κυτοκίνη στη συνέχεια διεγείρει την παραγωγή άλλων φλεγμονωδών κυτοκινών όπως της IL-6, που ενεργοποιούν όλα τα κύτταρα που συμμετέχουν στην φλεγμονή π.χ. ενδοθηλιακά κύτταρα, μονοκύτταρα, μακροφάγα Μ1, λεμφοκύτταρα Τh1, λείες μυϊκές ίνες.
Επιπλέον η IL-1β προκαλεί την έξοδο των ανοσοκυττάρων από το αίμα στο εσωτερικό των ιστών, αυξάνει τη συγκόλληση των αιμοπεταλίων, δημιουργεί πυρετό, προκαλεί αγγειοδιαστολή κ.λ.π.
Η Ιντερλευκίνη (IL)-1 υπάρχει σε 2 διαφορετικές μορφές, την IL-1β και την IL-1α που δρουν στον υποδοχέα IL-1 (IL-1 Receptor).
Η Ιντερλευκίνη (IL)-1 είναι η αρχική φλεγμονώδης ουσία της οξείας και χρόνιας φλεγμονής.
Μέσω των ανωτέρω μηχανισμών η οx LDL διεγείρει τα μακροφάγα σε έκκριση ROS και φλεγμονωδών κυτοκινών TNF, IL-1β, IL-18, MCP-1, and IL-8 που έλκουν και άλλα είδη λευκοκυττάρων στην περιοχή.
Μεταξύ των άλλων ειδών λευκοκυττάρων επιστρατεύονται και τα Λεμφοκύτταρα T helper 1 (Th-1), που εισχωρούν και αυτά κάτω από το ενδοθήλιο και βοηθούν μέσω της IFN-γ, στη μετατροπή των μονοκυττάρων σε μακροφάγα.
# Επιπλέον η είσοδος της LDL χοληστερίνης στο εσωτερικό τοίχωμα της αρτηρίας, οφείλεται και σε βλάβη του ενδοθηλίου και από άλλους παράγοντες.
Η βλάβη του ενδοθηλίου δημιουργείται από αυξημένη LDL Χοληστερίνη, από Υπέρταση, από Κάπνισμα, από Σ. Διαβήτη, αλλά και από μηχανικά ερεθίσματα (στροβιλώδης ροή του αίματος κυρίως σε διχασμούς των αρτηριών) από τις φλεγμονώδεις Κυτοκίνες κ.λ.π.
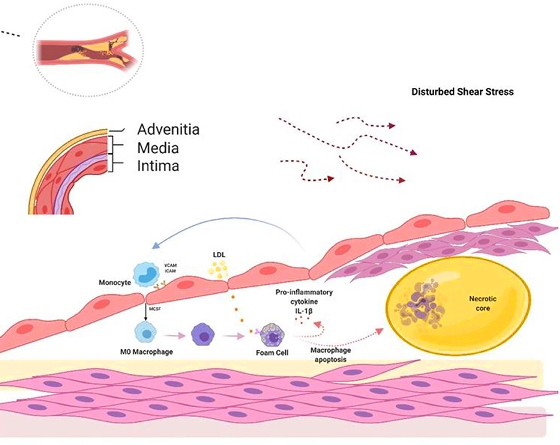
Οι αθηροσκληρωτικές πλάκες δημιουργούνται σε σημεία όπως οι διακλαδώσεις και οι καμπύλες των αρτηριών όπου υπάρχει τυρβώδης ροή (με χαμηλή διατμητική τάση- shear stress <5 dynes/cm2) οπότε τα ενδοθηλιακά κύτταρα χάνουν την ευθυγράμμιση τους με αποτέλεσμα να αυξάνεται η δυνατότητα στις απολιποπρωτείνες Β 100 να εισχωρούν κάτω από αυτά.
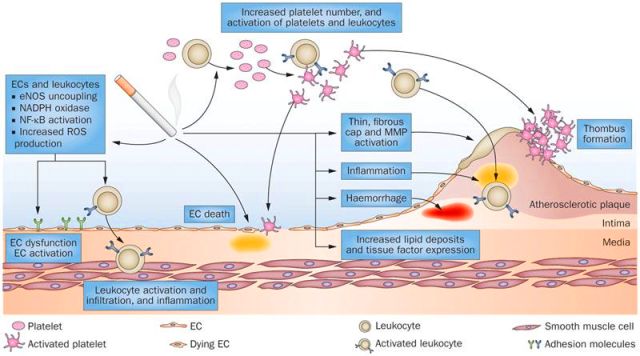
Η βλάβη- δυσλειτουργία των ενδοθηλιακών κυττάρων τα μετατρέπει σε κύτταρα που ευνοούν τη φλεγμονή, τη δημιουργία θρόμβων και ακυρώνουν το ρόλο τους σαν φράγματος, ανάμεσα στο αίμα και στο υπόλοιπο αρτηριακό τοίχωμα.
Τα δυσλειτουργικά ενδοθηλιακά κύτταρα παράγουν NF-κB (Nuclear Factor κΒ) που προκαλεί την δημιουργία υποδοχέων VCAM-1 (οπότε αυξάνεται η προσκόλληση μονοκυττάρων), υποδοχέων Toll–like 2, στην επιφάνεια τους, ROS, και πολλών φλεγμονωδών Κυτοκινών (MCP-1 και IL 8).
# Έτσι από το συνδυασμό στροβιλώδους ροής και δράσης των φλεγμονωδών Κυτοκινών, αλλάζει το σχήμα των ενδοθηλιακών κυττάρων και χάνεται η ευθυγράμμιση τους, οπότε αφήνουν κενά απ’ όπου εισχωρεί επιπλέον LDL και οι άλλες λιποπρωτεΐνες apo-β-100 μέσα στον έσω χιτώνα (το εσωτερικό στρώμα) του αρτηριακού τοιχώματος.
Επιπλέον προκαλείται μείωση της παραγωγής του ωφέλιμου Μονοξειδίου του Αζώτου (ΝΟ) από αυτά, παράγονται ROS και αυξάνεται η endothelin-1, οπότε δημιουργείται αγγειόσπασμος.
# Τα μακροφάγα στη συνέχεια είτε θα αποδώσουν την ox LDL στα apo A1 σωματίδια για να δημιουργηθούν τελικά τα ώριμα σωματιδίων της HDL χοληστερίνης που θα γυρίσουν τη χοληστερίνη στο ήπαρ (αντίστροφη μεταφορά χοληστερίνης– RCT) είτε θα μεταναστεύσουν από το αρτηριακό τοίχωμα στους λεμφαδένες.
# Όταν όμως η είσοδος της ox-LDL υπερβαίνει την έξοδο της από τα φαγοκύτταρα, αυτά μετατρέπονται σε αφρώδη κύτταρα, γεμάτα χοληστερίνη.
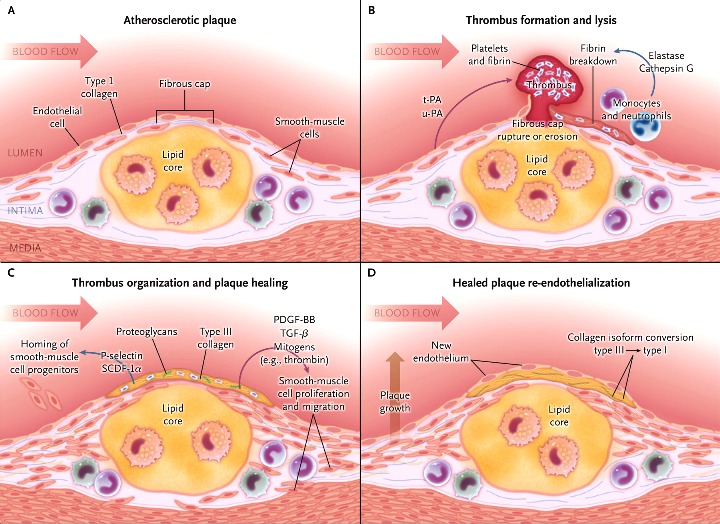
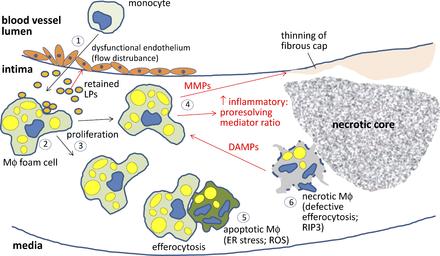
# Tα αφρώδη κύτταρα που έχουν απορροφήσει μεγάλη ποσότητα οx-LDL, διαλύονται-νεκρώνονται (απόπτωση) και δημιουργούν τον λιπώδη πυρήνα της αθηροσκληρωτικής πλάκας.
# Στην εξέλιξη της πλάκας συμμετέχουν και λείες μυϊκές ίνες (VSΜC) που βοηθούν στη δημιουργία του νεκρωτικού πυρήνα της (μέσω μεταβολής τους σε κύτταρα που μοιάζουν στα μακροφάγα και τελικά του θανάτου τους) ταυτόχρονα όμως αποτρέπουν τη ρήξη της, μέσω μετανάστευσης αμετάβλητων VSΜC κάτω από το ενδοθήλιο όπου δημιουργούν την ινώδη κάψα της.
Οι λείες μυϊκές ίνες από τον μέσο χιτώνα του αγγείου (VSMC) διεγείρονται από την ox-LDL, πολλαπλασιάζονται και μερικές από αυτές μεταβάλλονται σε κύτταρα που μοιάζουν στα μακροφάγα (με μειωμένες όμως τις δράσεις της φαγοκύττωσης και του “καθαρισμού” των νεκρών κυττάρων- efferocytosis). Αργότερα μέσω του θανάτου τους αυξάνεται ο λιπώδης νεκρωτικός πυρήνας της πλάκας.
Άλλες λείες μυϊκές ίνες μετατρέπονται σε κύτταρα που μοιάζουν με οστικά κύτταρα και εναποθέτουν Ασβέστιο.
Ενώ άλλες λείες μυϊκές ίνες που δεν μεταβλήθηκαν, έλκονται κάτω από το ενδοθήλιο όπου ασκούν προστατευτική δράση για την αποτροπή ρήξης της πλάκας μέσω της δημιουργίας παχιάς ινώδους κάψας (και έκκρισης κολλαγόνου).
http://circres.ahajournals.org/content/118/4/692
Λόγω της φλεγμονής, Λείες μυϊκές ίνες από τον μέσο χιτώνα του αγγείου μετατρέπονται σε κύτταρα που δρουν σαν οστικά κύτταρα και εναποθέτουν Ασβέστιο στην αθηρωματική πλάκα.
Το Ασβέστιο αρχίζει να εναποτίθεται στην αθηρωματική πλάκα, στην προσπάθεια του οργανισμού για “θεραπεία” της και όταν αυτό αυξηθεί σε σημαντικό βαθμό (Macro-Calcification) μετριέται από το score Ασβεστίου των στεφανιαίων αρτηριών (CAC).
# Όμως η φλεγμονή μπορεί να εξελιχτεί σε συνεχή-χρόνια φλεγμονή
1) είτε λόγω αδυναμίας εξουδετέρωσης της φλεγμονής.
2) είτε λόγω συνεχιζόμενης- επιμένουσας διέγερσης της φλεγμονής από συνεχόμενη είσοδο LDL Χοληστερίνης (και από Υπέρταση, Κάπνισμα, Σ. Διαβήτη κ.λ.π.)
Υπ’ όψιν ότι ακόμη και ένα πλούσιο σε θερμίδες γεύμα (κυρίως από κεκορεσμένα και trans λιπαρά) προκαλεί παραγωγή ROS που επιτείνουν την φλεγμονή.
3) είτε λόγω ανεπάρκειας του συστήματος αντίστροφης μεταφοράς χοληστερίνης.
# Και στις τρεις πιο πάνω περιπτώσεις δημιουργούνται αθηροσκληρωτικές πλάκες που αυξάνονται μέσω επαναλαμβανόμενων κύκλων νεκρώσεως των μακροφάγων και των αφρωδών κυττάρων.
# Τελικά όταν ο οργανισμός δεν μπορεί να αφαιρέσει- καθαρίσει (μέσω efferocytosis) τα υπολείμματα των νεκρωμένων κυττάρων (που είχαν “φάει” προηγουμένως την ox-LDL) και να επιδιορθώσει και επουλώσει την αρχική φλεγμονώδη προσβολή, εξελίσσεται η Αθηροσκληρωτική πλάκα που περιέχει λιπίδια σε διάφορες μορφές, κύτταρα ζωντανά, ετοιμοθάνατα και νεκρά (μακροφάγα, αφρώδη, λείες μυϊκές ίνες κ.λ.π.) και αργότερα και Ασβέστιο.
Η ΕΞΕΛΙΞΗ ΤΩΝ ΑΘΗΡΟΣΚΛΗΡΩΤΙΚΩΝ ΠΛΑΚΩΝ
# Οι αθηροσκληρωτικές πλάκες έχουν δυο πιθανές εξελίξεις:
1) είτε να μετατραπούν σε σκληρές πλάκες (που στενεύουν τον αυλό του αγγείου και μειώνουν την ροή του αίματος λίγο ή πολύ) με λίγη χοληστερίνη, πολλά λεία μυϊκά κύτταρα (και άλλα στοιχεία συνδετικού ιστού) και Ασβέστιο.
2) είτε να μετατραπούν σε μαλακές πλάκες (ευάλωτες) με πολλή χοληστερίνη και λεπτή ινώδη κάψα με λίγα λεία μυϊκά κύτταρα. Επίσης σ’ αυτές είναι πολύ αυξημένα τα μακροφάγα και τα μικροαγγεία μέσα στο αγγείο (vasa vasorum).
# Οι μαλακές πλάκες ασχέτως μεγέθους (δηλαδή και κάτω από το 50% της διαμέτρου του αυλού) μπορεί να υποστούν ρήξη οπότε αιμορραγούν προς τον αυλό της αρτηρίας. Ο οργανισμός δημιουργεί θρόμβο πάνω στην πλάκα για να σταματήσει την αιμορραγία.
Ο θρόμβος όμως αποφράσσει τελείως τον αυλό της αρτηρίας και σταματά τη ροή του αίματος.
Υπ’ όψιν ότι συχνά οι πλάκες υφίστανται ρήξη, χωρίς να δημιουργείται έμφραγμα ή εγκεφαλικό, λόγω του ότι οι λείες μυϊκές ίνες που βρίσκονται στο περίβλημα της αθηροσκληρωτικής πλάκας, επιδιορθώνουν την ρωγμή και επιπλέον γίνεται αυτόματη διάλυση του θρόμβου από την πλασμίνη.
# Αν ο οργανισμός καταφέρει να διαλύσει πλήρως το θρόμβο σε λιγότερο από μισή ώρα τα κύτταρα που αρδεύονταν από την αρτηρία επιβιώνουν και επανέρχονται στο φυσιολογικό.
Αν καταφέρει να προκαλέσει κερματισμό του και τα μικρά κομμάτια θρόμβου αποφράξουν μικρά αρτηρίδια δημιουργείται το έμφραγμα NSTEMI μόνο στο εσωτερικό 1/3 του τοιχώματος της αριστερής κοιλίας.
# Αν ο θρόμβος δεν διαλυθεί, τα κύτταρα που αρδεύονταν από την συγκεκριμένη αρτηρία νεκρώνονται λόγω του ότι δεν παίρνουν Οξυγόνο και δημιουργείται το έμφρακτο (= νέκρωση κυττάρων) του μυοκαρδίου (έμφραγμα STEMI σε όλο το πάχος του τοιχώματος) ή του εγκεφάλου (ισχαιμικό εγκεφαλικό επεισόδιο).
ΣΥΜΠΕΡΑΣΜΑΤΙΚΑ
Στη δημιουργία, εξέλιξη και ρήξη των Αθηροσκληρωτικών Πλακών συμμετέχουν:
* Η αυξημένη LDL χοληστερίνη, η είσοδος της κάτω από το ενδοθήλιο και η μετατροπή της σε οx–LDL.
* Η είσοδος των Υπολειμμάτων (Remnants) των VLDL και των Χυλομικρών κάτω από ενδοθήλιο χωρίς να οξειδωθούν και επίσης των ελεύθερων λιπαρών οξέων (FFA).
* Η βλάβη του ενδοθηλίου από στροβιλώδη ροή και από τους άλλους παράγοντες κινδύνου (Κάπνισμα, Υπέρταση, Σ. Διαβήτης κ.λ.π.).
* Μεταβληθείσες λείες μυϊκές ίνες σε κύτταρα που μοιάζουν με μακροφάγα με μειωμένη όμως απόδοση- λειτουργικότητα.
* Κύτταρα της εγγενούς ανοσίας (όπως μονοκύτταρα, μακροφάγα) και της επίκτητης ανοσίας (όπως τα λεμφοκύτταρα Τh1).
# Η LDL χοληστερίνη που εισχωρεί στο τοίχωμα της αρτηρίας μετατρέπεται σε οξειδωμένη LDL– ox–LDL, (λόγω αύξησης των ελευθέρων ριζών ROS ή από μειωμένη αποτελεσματικότητα των αντι-οξειδωτικών μηχανισμών).
# Η οx–LDL θεωρείται από τον οργανισμό βλαβερή ουσία που πρέπει να καταπολεμηθεί- εξουδετερωθεί.
# Έτσι επιστρατεύονται μονοκύτταρα από το αίμα που μετατρέπονται σε Μακροφάγα Μ1 κύτταρα για να εξουδετερώσουν την ox-LDL “τρώγοντας” την. Όταν τα Μακροφάγα φορτωθούν με πολύ Χοληστερίνη μετατρέπονται σε αφρώδη κύτταρα.
# Η ox-LDL και οι κρύσταλλοι Χοληστερίνης που έχουν φαγωθεί από τα Μακροφάγα προκαλούν την παραγωγή Ιντελευκίνης IL-1β και IL-18 από αυτά (μέσω του NLRP3 inflammasome).
* Οι εντολές και οι αλληλεπιδράσεις μεταξύ όλων των κυττάρων της φλεγμονής και της οx–LDL γίνονται από ουσίες που λέγονται Κυτοκίνες με πιο σπουδαία την αρχική IL-1β.
* Το μέγεθος των Αθηροσκληρωτικών Πλακών αυξάνεται, αν ο μηχανισμός της αντίστροφης μεταφοράς χοληστερίνης υπολειτουργεί ή συνεχίζεται η είσοδος LDL χοληστερίνης ή/και συνεχίζεται η βλάβη του ενδοθηλίου ή επιμένει- αυτοδιαιωνίζεται η φλεγμονή από τα αμυντικά κύτταρα του οργανισμού.
* Οι αθηροσκληρωτικές πλάκες αυξάνονται σε μέγεθος μέσω επαναλαμβανόμενων κύκλων νεκρώσεως των μακροφάγων και των αφρωδών κυττάρων.
* Η αθηροσκληρωτική πλάκα ασχέτως μεγέθους μπορεί να σπάσει- ραγεί προς τον αυλό της αρτηρίας, αν είναι μαλακή με μεγάλο λιπώδη πυρήνα και λεπτή προστατευτική ινώδη κάψα και αν υπάρχει έντονη φλεγμονή σ’ αυτήν.
* Ο οργανισμός δημιουργεί θρόμβο πάνω στην πλάκα για να σταματήσει την αιμορραγία, όμως έτσι σταματά τη ροή του αίματος, οπότε μπορεί να συμβεί οξύ έμφραγμα του μυοκαρδίου (αν η πλάκα βρίσκεται σε στεφανιαία αρτηρία) ή ισχαιμικό εγκεφαλικό επεισόδιο (αν η πλάκα βρίσκεται σε αρτηρία του εγκεφάλου ή στην έσω καρωτίδα).
* Η σημερινή θεραπεία της Στεφανιαίας Νόσου, περιλαμβάνει τις Στατίνες (που μειώνουν την LDL χοληστερίνη), την Ασπιρίνη (που μειώνει τη δημιουργία θρόμβων σε ραγείσες πλάκες δρώντας αντιαιμοπεταλιακά) και τους β-αναστολείς (που μειώνουν τις ανάγκες του μυοκαρδίου σε οξυγόνο).
* Τελικά φαίνεται όμως ότι θα αρχίσουμε σύντομα να χρησιμοποιούμε και ορισμένα αντιφλεγμονώδη φάρμακα, ιδίως σε αυτούς που παρ’ όλη την μεγάλη μείωση της LDL χοληστερίνης στο αίμα (π.χ. 40-50 mg/dL) συνεχίζουν να εξελίσσουν αθηρωματικές πλάκες (ή/και έχουν αυξημένη CRP).
ΕΝΔΕΙΚΤΙΚΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
https://www.sciencedirect.com/science/article/pii/S0092867422004007#bib92
http://jaha.ahajournals.org/content/6/3/e005543
http://journal.frontiersin.org/article/10.3389/fimmu.2017.00043/full
https://www.ncbi.nlm.nih.gov/pubmed/24864079
https://www.ncbi.nlm.nih.gov/books/NBK343489/
http://circres.ahajournals.org/content/118/1/145
https://academic.oup.com/eurheartj/article-lookup/doi/10.1093/eurheartj/ehv759
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5382975/
http://pharmrev.aspetjournals.org/content/65/1/47.long
http://jcb.rupress.org/content/209/1/13
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8037897/
https://www.mdpi.com/1422-0067/23/6/3346/htm
https://academic.oup.com/eurheartj/article/43/16/1569/6525629
https://www.sciencedirect.com/science/article/pii/S2452302X21000255