ΟΙ ΓΟΝΙΔΙΑΚΕΣ ΘΕΡΑΠΕΙΕΣ
Το μέλλον έχει φτάσει. Τα τελευταία χρόνια γίνεται μια επανάσταση με “γονιδιακά” φάρμακα. Με αυτά ο άνθρωπος μπορεί να παρεμβαίνει στη φύση, θεραπεύοντας ασθένειες που μέχρι πριν λίγο θεωρούνταν ανίατες.
Με τα “γονιδιακά” φάρμακα μπορούμε να παρεμβαίνουμε σε συγκεκριμένους στόχους και μελλοντικά θα θεραπεύονται με αυτά πολλές νόσοι γονιδιακές και μη (π.χ. καρκίνοι, καρδιαγγειακές παθήσεις, ιώσεις κλπ.) στοχευμένα – εξειδικευμένα και με λιγότερες παρενέργειες.
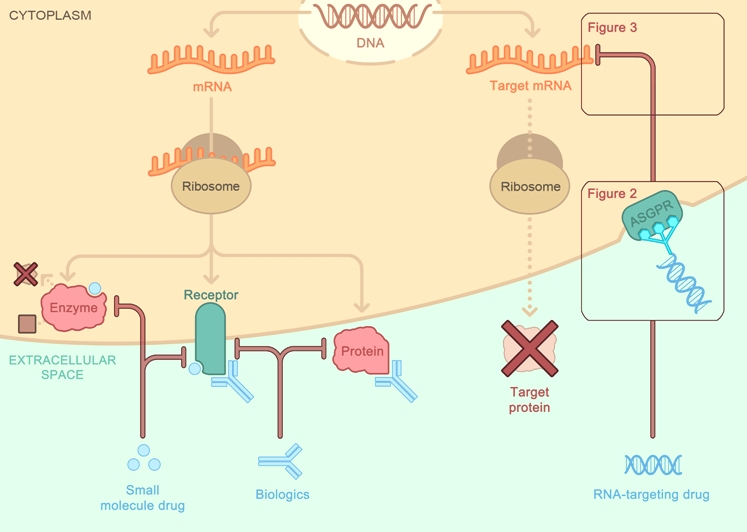
Τα άλλα φάρμακα παρεμβαίνουν σε υποδοχείς, πρωτεΐνες και ένζυμα-πρωτεΐνες (π.χ. μικρομοριακά φάρμακα και μονοκλωνικά αντισώματα).
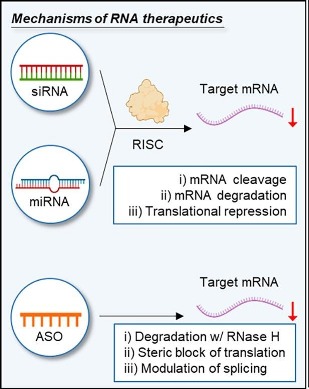
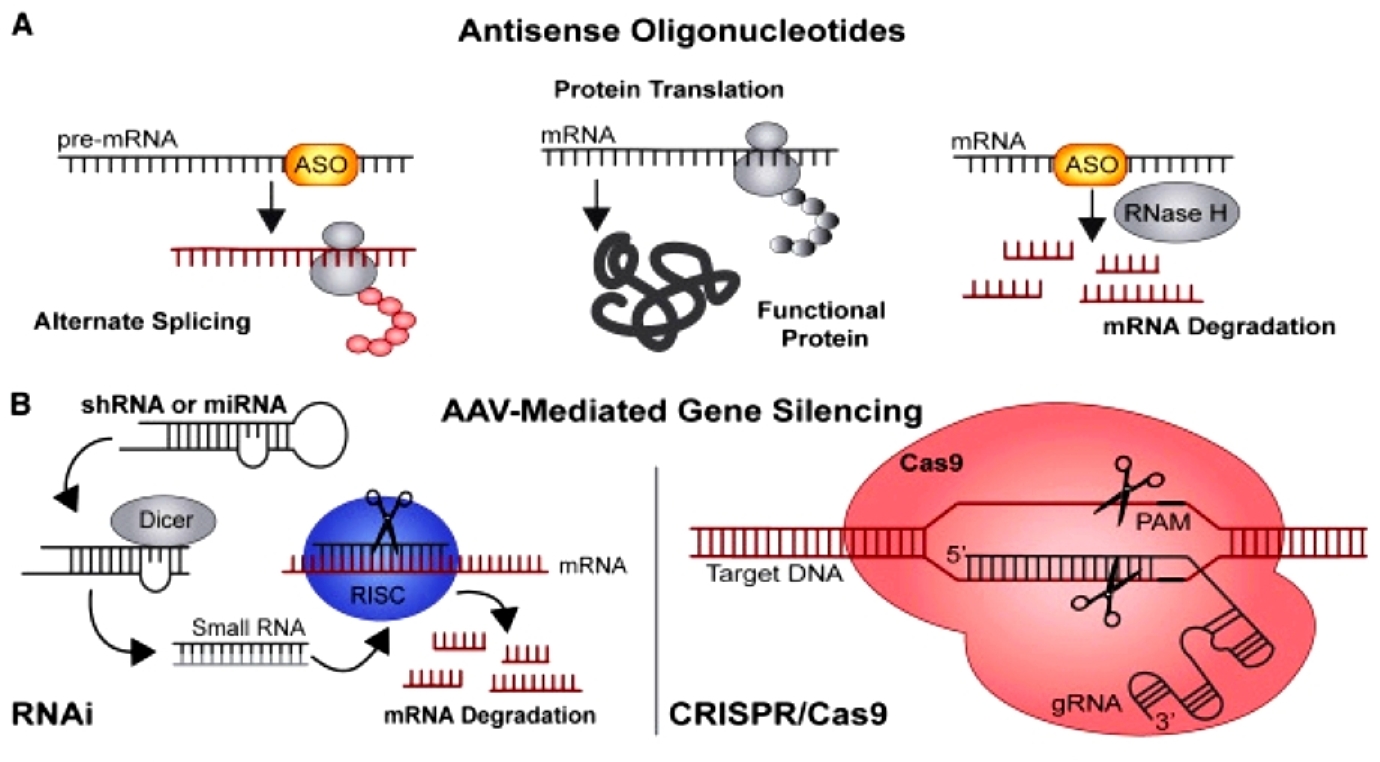
>>> Μια κατηγορία “γονιδιακών” φαρμάκων είναι αυτά που έχουν στόχο το αγγελιοφόρο RNA (messenger RNAή mRNA) συνήθως σταματώντας εξειδικευμένα τη δημιουργία ορισμένων ανεπιθύμητων πρωτεϊνών (Gene silencing). Αυτά είναι τα φάρμακα ASO και τα φάρμακα siRNA.
>>> Μια άλλη κατηγορία γονιδιακών φαρμάκων χρησιμοποιεί ένα νέο γονιδιακό εργαλείο το CRISPR-Cas9 που επεμβαίνει και επεξεργάζεται απευθείας το DNA στον πυρήνα των κυττάρων. Η μεταβολή του DNA είναι μόνιμη με αυτή τη μέθοδο. (Δες πιο κάτω)
Τα φάρμακα ASO και τα φάρμακα siRNA
Οι γονιδιακές θεραπείες που αφορούν τη χορήγηση συγκεκριμένων τμημάτων DNA ή RNA (Δες στο τέλος) που έχουν στόχο το αγγελιοφόρο RNA και είναι κυρίως 2 κατηγοριών: Τα φάρμακα ASO και τα φάρμακα siRNA
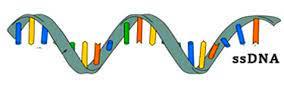
Συγκεκριμένα τα φάρμακα ASO αποτελούνται από μονή έλικα DNA και τα φάρμακα siRNA αποτελούνται από διπλή έλικα RNA (Δες μετά)
Πιο πάνω φαίνεται ASO με μονή έλικα DNA και siRNA με διπλή έλικα RNA
Πιο πάνω φαίνεται η κατασκευή του RNA και του DNA
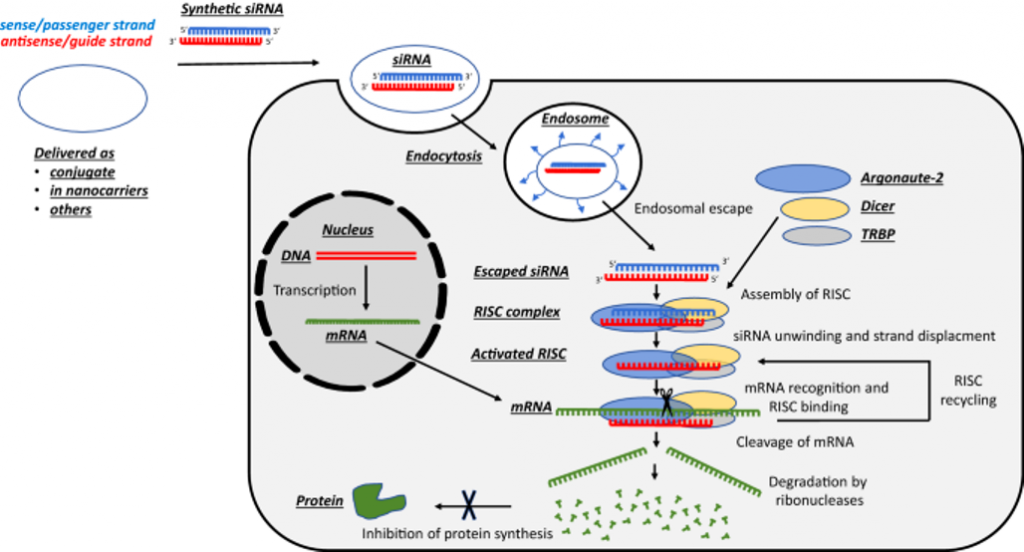
Για να δράσουν τα φάρμακα που έχουν στόχο το αγγελιοφόρο RNA πρέπει να υπερνικηθούν ορισμένα εμπόδια: Η είσοδος τους στο κυτταρόπλασμα των κυττάρων, η σταθερότητα τους και να αποφευχθεί η απάντηση της εγγενούς ανοσίας.
https://www.nature.com/articles/nbt.3802
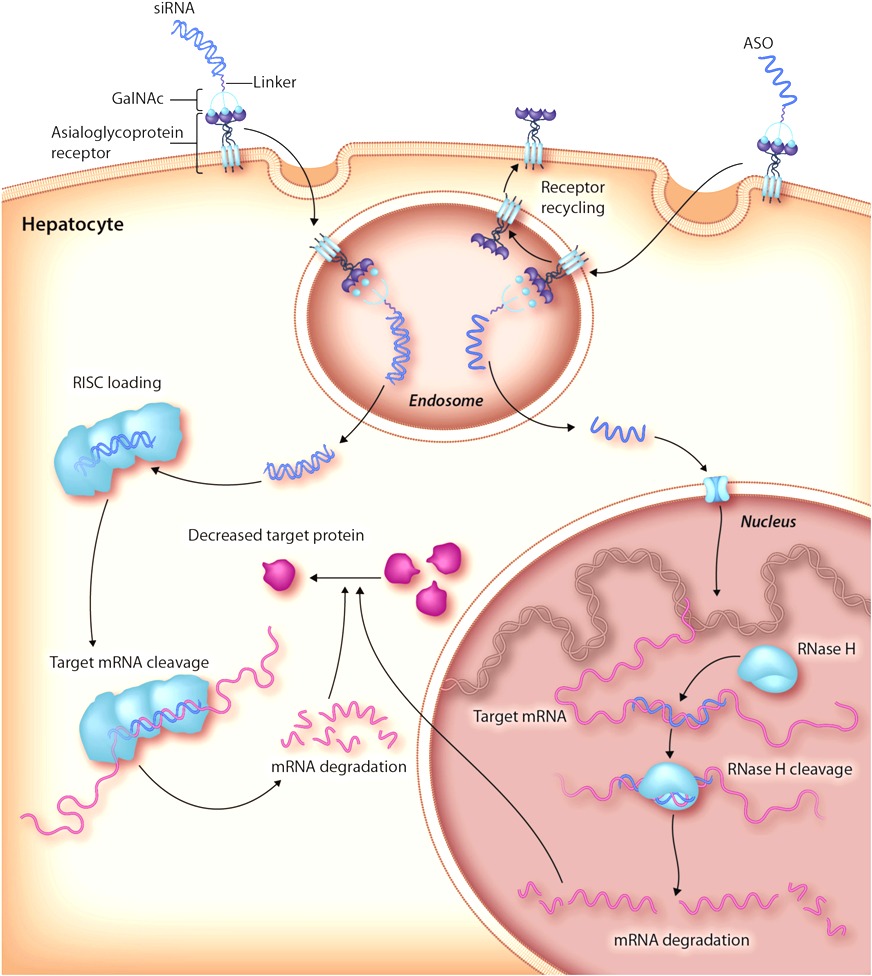
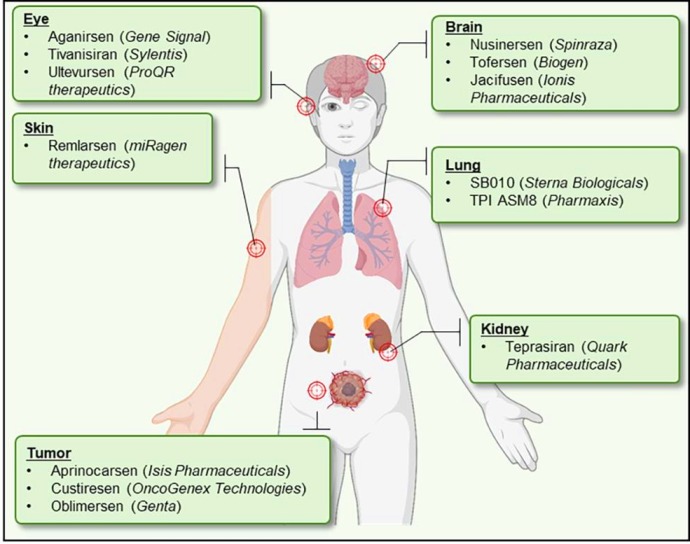
Προς το παρόν υπάρχει η τεχνολογία των φαρμάκων που παρεμβαίνουν στο mRNA με δράση στο ήπαρ [μέσω N-Ακετυλογαλακτοζαμίνης (GalNAc) ή λιπο-νανοσωματιδίων (LNPs)] και τα ASO (δες πιο κάτω) με τοπική χορήγηση στο Κεντρικό Νευρικό Σύστημα, τώρα όμως η έρευνα επικεντρώνεται στην είσοδο – δράση τους και σε άλλα όργανα.
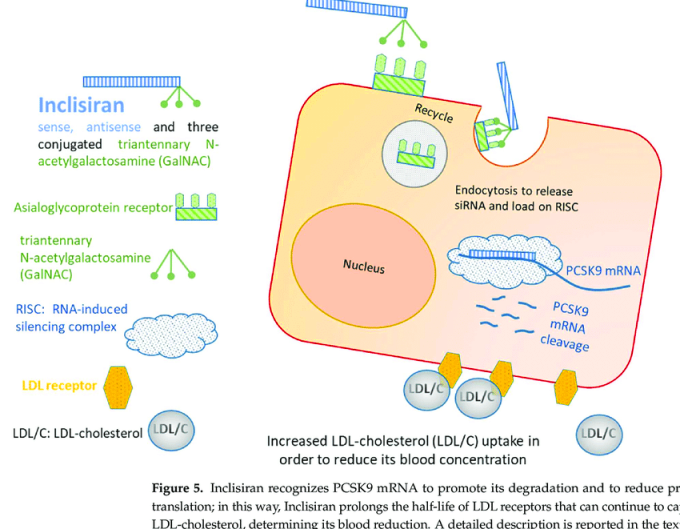
[Η GalNAc είναι απαραίτητη για την επικοινωνία μεταξύ των κυττάρων. Στη φαρμακευτική των φαρμάκων που μπλοκάρουν το mRNA, αυτή ενώνεται με τους ασιαλογλυκοπρωτεϊνικούς (asialoglycoprotein) υποδοχείς (ASGPR) των ηπατοκυττάρων]
https://www.sciencedirect.com/science/article/pii/S0169409X23003885
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016
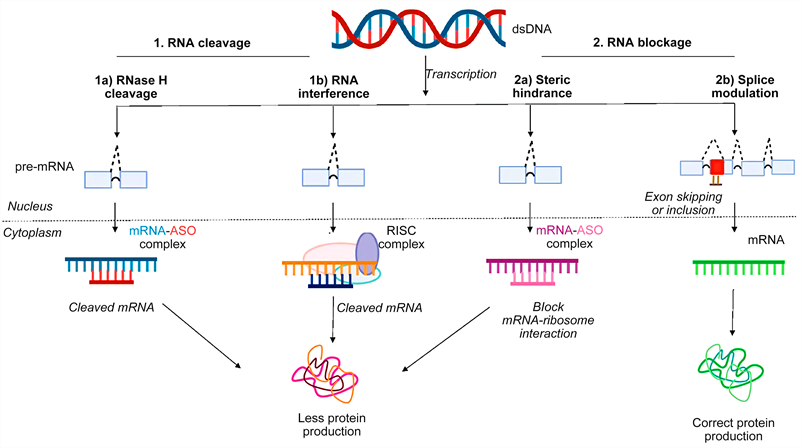
>> Μέχρι τώρα έχουν εγκριθεί ορισμένα “γονιδιακά” φάρμακα που επεμβαίνουν στο mRNA, δυο κατηγοριών,της κατηγορίας των Συμπληρωματικών Ολιγονουκλεοτιδίων (anti-sense oligonucleotide ή ASO) και των μικρών παρεμβαινόντων RNA (small-interfering RNA ή siRNA)
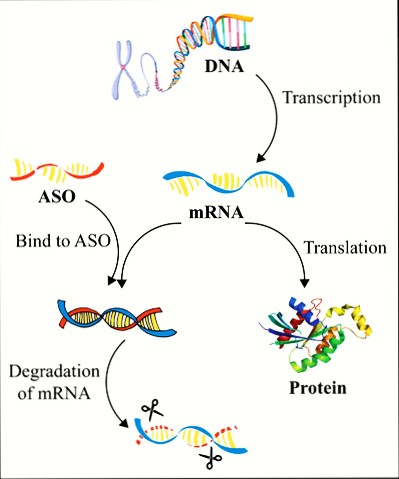
Αυτά μειώνουν ή καταστρέφουν το mRNA εμποδίζοντας τη μετάφραση (translation) του στην ανεπιθύμητη πρωτεΐνη. (δες στο τέλος)
Με την ευρεία έννοια και τα mRNA εμβόλια για τον κορωνοϊό SARS-CoV-2 είναι γονιδιακά φάρμακα – εμβόλια.
[Το εμβόλιο της Pfizer – BioNTech και το εμβόλιο της MODERNA περιέχουν messenger-RNA (mRNA), που χορηγείται στο σώμα, ώστε να κατασκευαστεί από τα κύτταρα μας η spike πρωτεΐνη αγκίστρωσης του SARS-CoV-2 στα κύτταρα μας.
Έτσι παράγονται αντισώματα από το ανοσοποιητικό μας σύστημα, έτοιμα για να μπλοκάρουν τη spike πρωτεΐνη του SARS-CoV-2 ώστε να μην μπορεί ο ιός να διεισδύσει στα κύτταρα μας αν μολυνθούμε από αυτόν μελλοντικά]
ΤΑ ΣΥΜΠΛΗΡΩΜΑΤΙΚΑ ΟΛΙΓΟΝΟΥΚΛΕΟΤΙΔΙΑ (ASO)
Τα φάρμακα συμπληρωματικά ολιγονουκλεοτίδια ή ASO (ΑntiSense Oligonucleotide), μειώνουν την παραγωγή πρωτεΐνης από ένα γονίδιο [μειώνουν την έκφραση (μετάφραση) του γονιδίου στην αντίστοιχη πρωτεΐνη του]. Αυτά έχουν κατάληξη σε rsen.
Θεωρούνται ιδανικά φάρμακα για θεραπείες ακριβείας, με ελάχιστες παρενέργειες και μακρά διάρκεια δράσεως.
[Όμως τα φάρμακα ASO μπορεί να σχεδιαστούν να αυξάνουν κάποια πρωτεΐνη στόχο αν ενωθούν με miRNA που τη μειώνει (δες πιο κάτω).
Για παράδειγμα το miR-21 μειώνει τη δράση γονιδίων που καταπιέζουν τη δημιουργία όγκων, οπότε αυξάνει την ογκογένεση, οπότε ένα φάρμακο ASO που θα μπλοκάρει το miR-21, θα μειώνει την ογκογένεση]
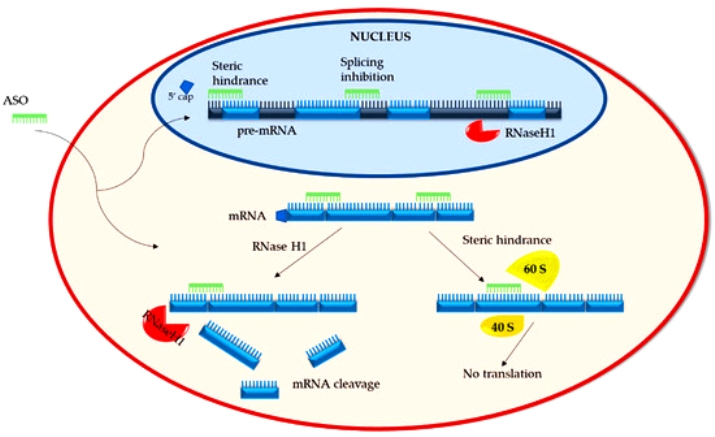
Τα φάρμακα συμπληρωματικά ολιγονουκλεοτίδια αποτελούνται από μια μονή έλικα συνθετικού DNA (δεοξυριβονουκλεϊκό οξύ) που ενώνεται με το αγγελιοφόρο RNA (messenger ή mRNA) στόχο του και σταματά την μετάφραση- παραγωγή της αντίστοιχης πρωτεΐνης από τα ριβοσώματα των κυττάρων του ήπατος και του κεντρικού νευρικού συστήματος (με τοπική έγχυση) προς το παρόν.
Αυτά έχουν συνήθως 12 με 25 βάσεις DNA και ενώνονται στο αντίστοιχο mRNA, μέσω των συμπληρωματικών βάσεων.
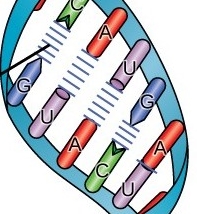
Οι ενώσεις μεταξύ των απέναντι βάσεων είναι πάντα G με C , C με G , A με U , Τ με Α. (Το mRNA αντί για Τ έχει U, οπότε η Α ενώνεται με U) Δες στο τέλος
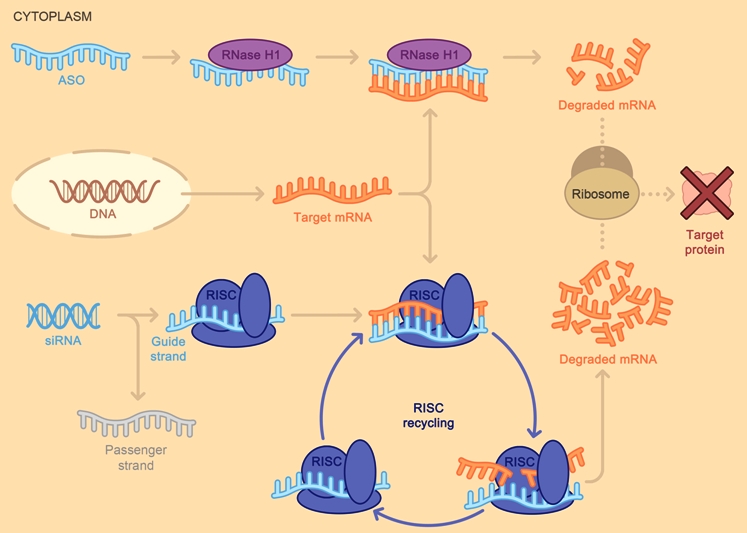
Όταν συμβεί η ένωση του συμπληρωματικού ολιγονουκλεοτιδίου (ASO) με το mRNA, σταματά η παραγωγή της αντίστοιχης πρωτεΐνης στόχου, με διάφορους μηχανισμούς και κυριότερο την καταστροφή του mRNA από το ένζυμο Ριβονουκλεάση Η1.
Τα εγκεκριμένα φάρμακα ASO, από το FDA, μέχρι στιγμής είναι 10:
# Το Mipomersen (Kynamro) που μειώνει την παραγωγή της πρωτεΐνης Apo B 100 και ενδείκνυται για την ομόζυγη οικογενή Υπερχοληστεριναιμία (HoFH).
# Το Volanesorsen (Waylivra) που μειώνει την παραγωγή της απολιποπρωτεΐνης C-III (apoC-III) και χορηγείται σε ανθρώπους με Σύνδρομο οικογενούς Χυλομικροαιμίας (Familial Chylomicronemia Syndrome ή FCS), αλλά και σε ανθρώπους με ψηλή apoC–III ή/και ψηλά Τριγλυκερίδια νηστείας > 500 mg/dL, που είναι ταυτόχρονα ψηλού κινδύνου για Καρδιαγγειακά επεισόδια παρά τις υγιεινοδιαιτητικές αλλαγές και τη χρήση Στατίνης ή/και Φιμπράτης.
# Το Inotersen (Tegsedi), που μειώνει την παραγωγή της Τρανσθυρετίνης (TTR) και χορηγείται σε όσους έχουν πολυνευροπάθεια από Κληρονομική Αμυλοείδωση από Τρανσθυρετίνη (ATTRh amyloidosis). (Αυτή οφείλεται σε μετάλλαξη του γονιδίου της Τρανσθυρετίνης)
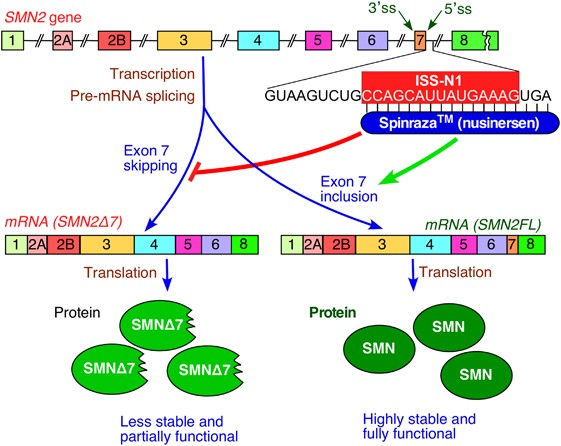
# Το Nusinersen (Spinraza) που χρησιμοποιείται στη Νωτιαία Μυϊκή Ατροφία (spinal muscular atrophy). [Αυτό στοχεύει τον intronic splicing silencer N1 (ISS-N1) ώστε τελικά το εξώνιο 7 συμπεριλαμβάνεται στο mRNA της SMN2, οπότε αυξάνεται η παραγωγή της λειτουργικής πρωτεΐνης SMN (Survival of Motor Neuron)]
https://ir.lib.uth.gr/xmlui/bitstream/handle/11615/58042/23714.pdf
# Tofersen (Qalsody) για τη θεραπεία της πλάγιας (πλευρικής) Αμυοτροφικής σκλήρυνσης (Amyotrophic Lateral Sclerosis ή ALS). Αυτό εξουδετερώνει το mRNA του μεταλλαγμένου γονιδίου SOD1, οπότε σταματά η παραγωγή των τοξικών πρωτεϊνών SOD1 που προκαλούν την πάθηση.
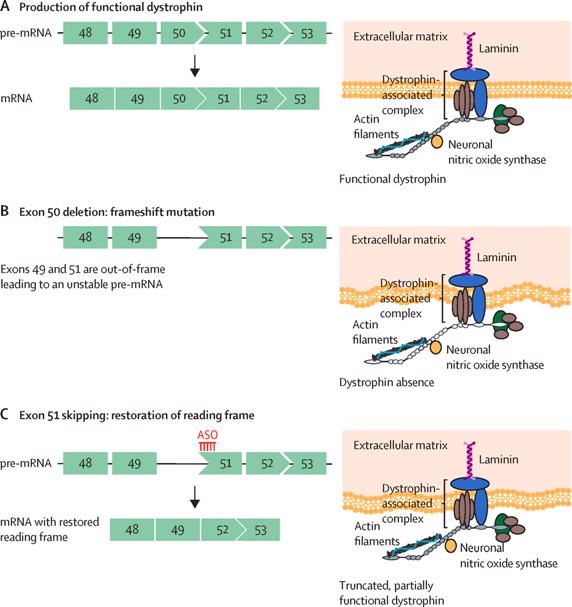
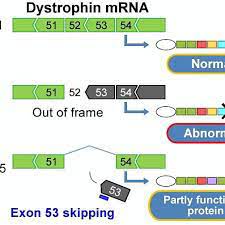
# Για τη θεραπεία της Μυϊκής Δυστροφίας Duchenne (Duchenne muscular dystrophy ή DMD) έχουν εγκριθεί 4 φάρμακα ASOs, που δρουν σε διάφορες μεταλλάξεις του γονιδίου της πρωτεΐνης Δυστροφίνης (απαραίτητη για τη λειτουργικότητα και ακεραιότητα των μυϊκών ινών) ώστε αυτή να παράγεται λειτουργική.
>> Το Eteplirsen (Exondys 51) που προκαλεί παράκαμψη του εξωνίου 51.
>> Το Golodirsen (Vyondys 53) και το Viltolarsen (Viltepso) που προκαλούν παράκαμψη του εξωνίου 53.
>> Το Casimersen (Amondys 45) που προκαλεί παράκαμψη του εξωνίου 45
# Το Formivirsen (Vitravene) είναι το πρώτο ASO που εγκρίθηκε το 1998. Αυτό χορηγείτο σε αμφιβληστροειδίτιδα από κυτταρομεγαλοϊό ή CMV (ιός με διπλή έλικα DNA ή dsDNA), αλλά λόγω ανακάλυψης άλλων αντι-ιικών φαρμάκων σταμάτησε να παράγεται.
(Ενώνεται με mRNA του ιού και σταματά την παραγωγή της πρωτεΐνης IE2, που χρειάζεται για τον πολλαπλασιασμό του)
# Πολλά άλλα ASO φάρμακα εξελίσσονται για διάφορες παθήσεις, π.χ για όσους έχουν αυξημένη Λιποπρωτεΐνη α ή Lp(a) εξελίσσεται το Pelacarsen (TQJ230)
https://classic.clinicaltrials.gov/ct2/show/NCT04023552
ΤΑ siRNA ΦΑΡΜΑΚΑ
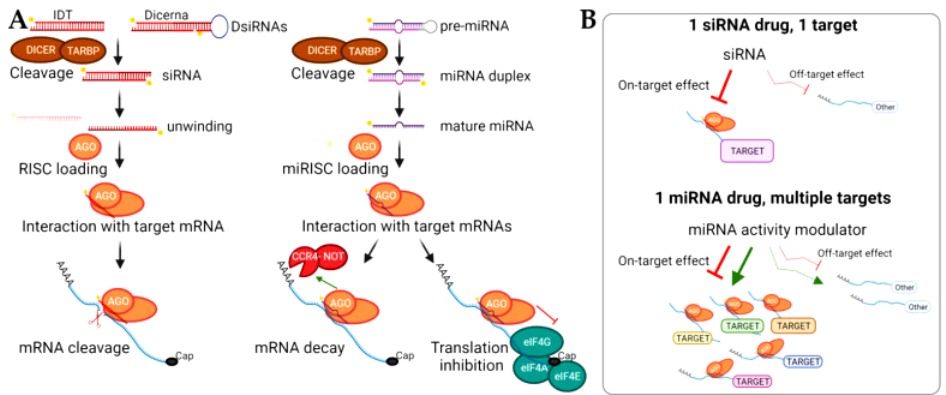
Τα siRNA (silencing RNA ή short interfering RNA) είναι μικρά ολιγονουκλεοτίδια RNA διπλής έλικας (double-stranded RNA) που παράγονται από το σώμα για άμυνα κατά ξένου εισβολέα που παρουσιάζει RNA και για μείωση της παραγωγής κάποιας πρωτεΐνης (όπως και τα mi RNA).
Αυτά έχουν κατάληξη σε siran.
Τα siRNA φάρμακα αποτελούνται από μικρό αριθμό βάσεων, συσσωρεύονται στο ήπαρ και κερματίζουν το mRNA της ανεπιθύμητης πρωτεΐνης που παράγεται σ’ αυτό. Υπ’ όψιν ότι γίνεται προσπάθεια να αναπτυχθούν και siRNA φάρμακα που να δρουν και σε άλλα όργανα.
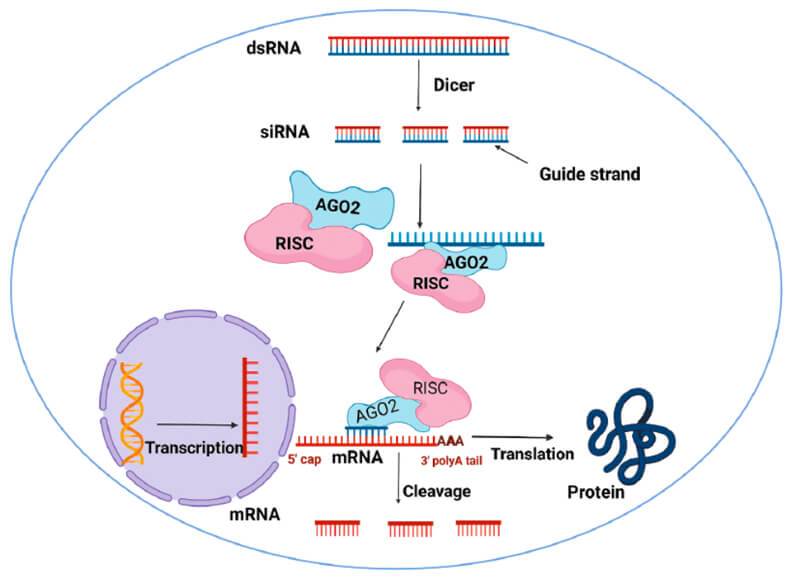
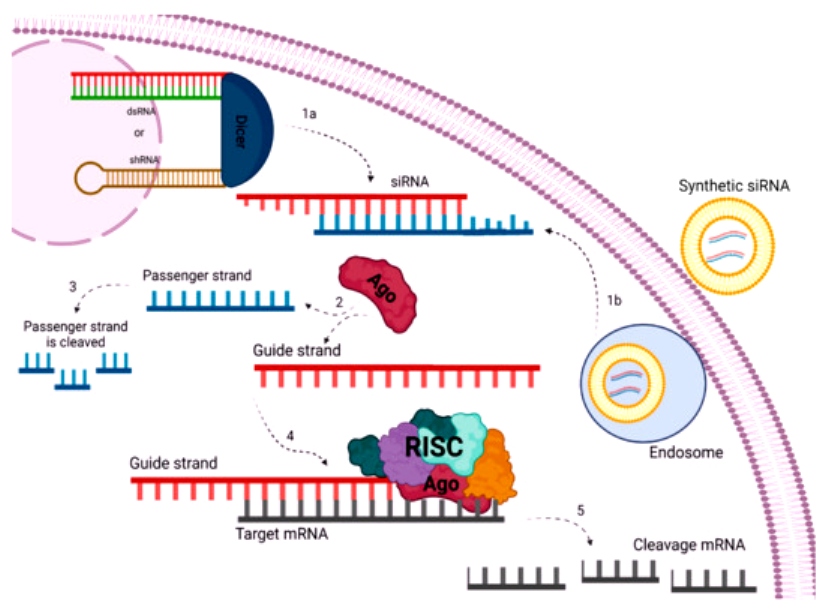
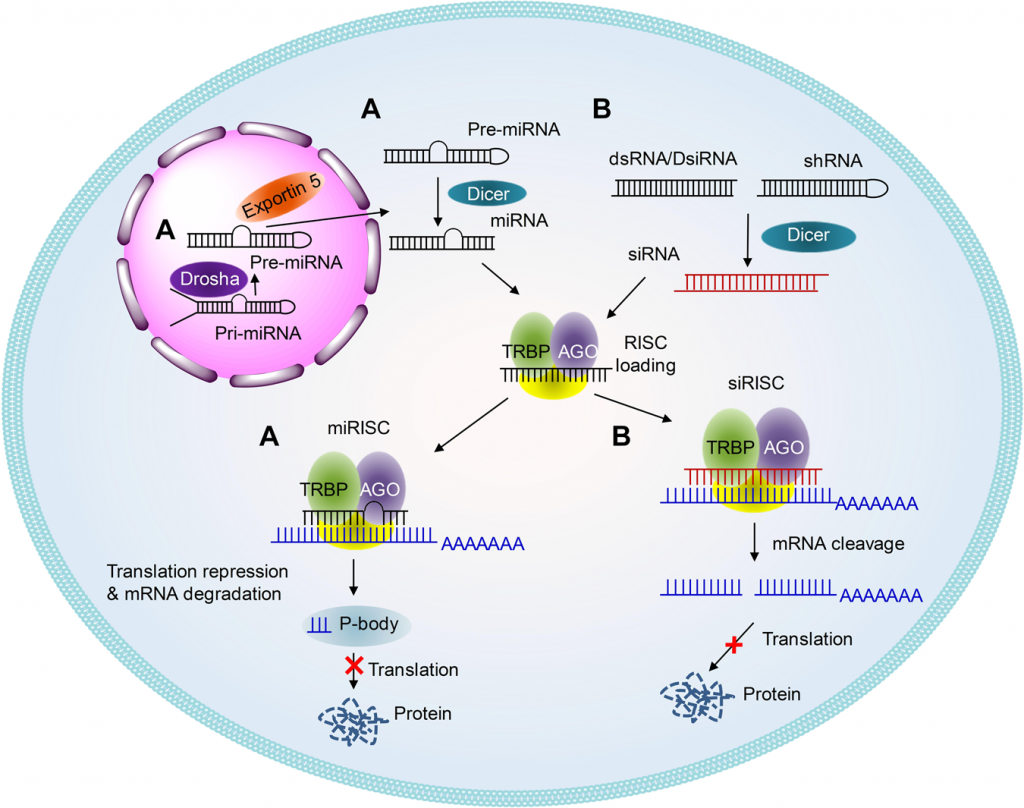
Το siRNA φάρμακο, αφού μπει στο κυτταρόπλασμα, ενώνεται με το σύμπλεγμα της πρωτεΐνης TRBP (transactivation RNA-binding protein) και Dicer (RNase III ενδοριβονεκλουάση ΙΙΙ) όπου διασπάται σε μικρότερα τμήματα διπλής έλικας των 19-23 ζευγών βάσεων.
Στη συνέχεια τα μικρότερα siRNA τμήματα μαζί με το σύμπλεγμα της πρωτεΐνης TRBP και Dicer, και με άλλες πρωτεΐνες – ένζυμα, όπως την Argonaute 2 (Ago-2) σχηματίζουν το σύμπλεγμα RISC (RNA Induced Silencing Complex).
Το σύμπλεγμα RISC αργότερα διασπά τα μικρότερα siRNA τμήματα διπλής έλικας σε 2 μονές έλικες. Η οδηγός έλικα (λέγεται anti sense), με το σύμπλεγμα RISC, ψάχνει, βρίσκει και ενώνεται με τον συμπληρωματικό mRNA στόχο της, ενώ η άλλη έλικα (μεταφορέας ή sense) καταστρέφεται.
Όταν το σύμπλεγμα RISC ενωθεί με τον mRNA στόχο, η πρωτεΐνη Ago-2 του συμπλέγματος τον κερματίζει οπότε δεν παράγεται η αντίστοιχη ανεπιθύμητη πρωτεΐνη στόχος.
[Η οδηγός έλικα είναι συμπληρωματική του mRNA στόχου, ενώ η άλλη έλικα που καταστρέφεται έχει την ίδια αλληλουχία βάσεων με τον mRNA στόχο]
Το siRNA ενώνεται ολόκληρο και εξειδικευμένα με το mRNA στόχο, οπότε δημιουργείται πλήρης αποδόμηση του mRNA στόχου της ανεπιθύμητης πρωτεΐνης.
Οπότε τα siRNA φάρμακα μπορούν να σχεδιαστούν να δρουν εναντίον οποιουδήποτε στόχου με απόλυτη εξειδίκευση (100% ειδικότητα).
[Αντίθετα το miRNA (δες πιο κάτω) ΔΕΝ δρα εξειδικευμένα μόνο σε ένα τμήμα mRNA, επειδή ενώνεται μόνο ένα μέρος του (λίγες βάσεις) στο mRNA, οπότε δρα σε διάφορα παρόμοια mRNAs, και έτσι σταματά την παραγωγή πολλών πρωτεϊνών, με αποτέλεσμα πέρα από το στόχο του να παρουσιάζει διάφορες παρενέργειες]
Μέχρι σήμερα έχουν εγκριθεί πέντε siRNA φάρμακα:
# Το Patisiran (Onpattro) και το Vutrisiran (Αmvuttra) είναι siRNA θεραπευτικοί παράγοντες που δρουν στο mRNA ώστε να μη δημιουργείται η πρωτεΐνη Τρανσθυρετίνη, σε πολυνευροπάθεια από κληρονομική Αμυλοείδωση από Τρανσθυρετίνη (ATTRh amyloidosis).
# Το Givosiran (Givlaari) για την οξεία ηπατική πορφυρία [σπάνιες γενετικές μεταβολικές παθήσεις που προκαλούν συσσώρευση πρόδρομων νευροτοξικών ουσιών της αίμης (συστατικό μόριο της αιμοσφαιρίνης)]
# Το Lumasiran (Oxlumo) για την πρωτογενή υπεροξαλουρία τύπου 1 (αυξημένη συσσώρευση οξαλικών αλάτων στα ούρα που μαζί με Ασβέστιο προκαλούν Νεφρολιθίαση και Νεφρική Ανεπάρκεια)
# Το Inclisiran (Leqvio) έχει εγκριθεί από το FDA για χορήγηση σε αθηρωματική καρδιαγγειακή νόσο (που προκαλεί έμφραγμα ή ισχαιμικό εγκεφαλικό) και σε ετερόζυγο οικογενή υπερχοληστεριναιμία, αν η δίαιτα και η μέγιστη ανεκτή δόση Στατίνης δεν είναι αρκετά για τη μείωση LDL της χοληστερίνης στο επιδιωκόμενο.
# Πολλά άλλα siRNA φάρμακα εξελίσσονται για διάφορες παθήσεις, π.χ για όσους έχουν αυξημένη Λιποπρωτεΐνη α ή Lp(a) εξελίσσονται το Olpasiran (AMG 890) και το Zerlasiran (SLN360)
NCT04270760, NCT03626662, https://classic.clinicaltrials.gov/ct2/show/NCT05537571
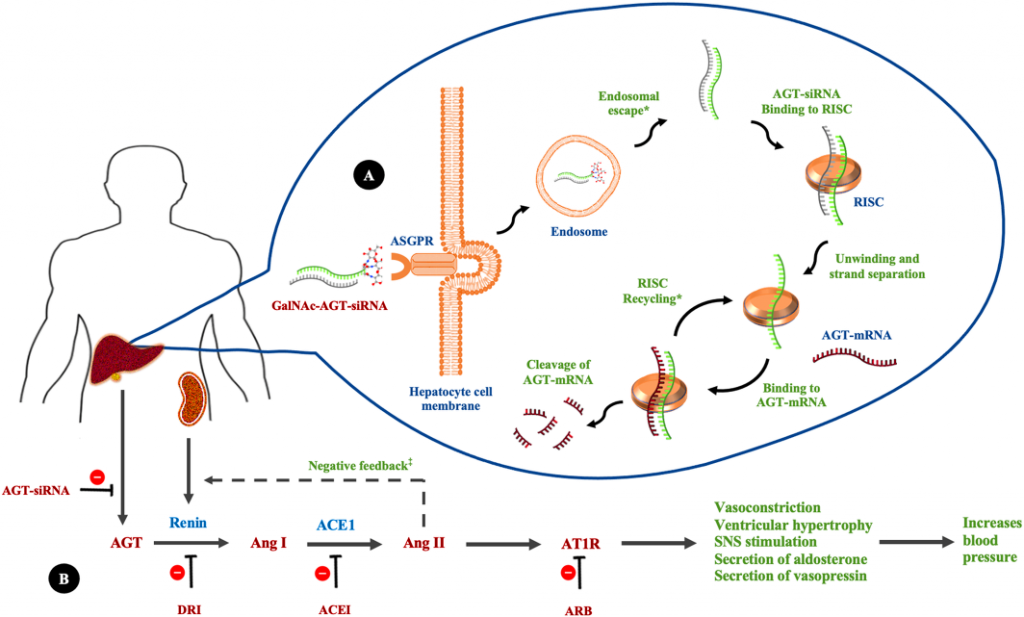
Επίσης εξελίσσεται το Zilebesiran (ALN‐AGT01) που σταματά τη σύνθεση του Αγγειοτενσινογόνου στο ήπαρ μειώνοντας την Υπέρταση.
https://www.nejm.org/doi/full/10.1056/NEJMoa2208391
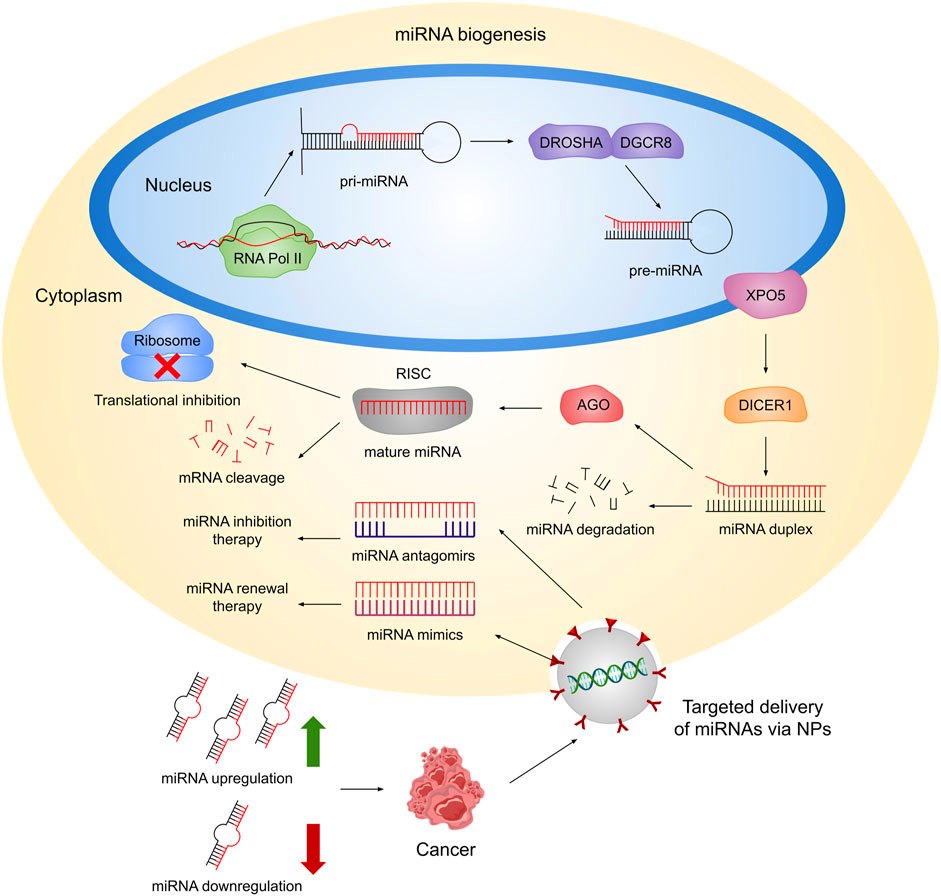
ΤΑ miRNAs
*Τα miRNAs (υπάρχουν σχεδόν 2.500 στο σώμα μας) είναι μικρά, με συνήθως 22 (18-25) νουκλεοτίδια (βάσεις) RNAs. Αυτά δεν δημιουργούν πρωτεΐνες (noncoding RNAs), όμως μειώνουν ή εμποδίζουν την παραγωγή πρωτεϊνών (μετάφραση).
Υπ’ όψιν ότι περισσότερα από το 50% των γονιδίων που οδηγούν σε παραγωγή πρωτεΐνης (coding genes) επηρεάζονται από ένα ή περισσότερα miRNAs.
Το επιτυγχάνουν με ένωση τους στο mRNA πολλών γονιδίων (μέσω του συμπλέγματος RISC) το κάθε ένα, εμποδίζοντας ή “καταστρέφοντας” το mRNA των γονιδίων αυτών.
Ο λόγος που δεν υπάρχει ακόμη φάρμακο με τεχνητό miRNA είναι αυτή η δράση τους σε πολλά γονίδια ταυτόχρονα, οπότε δεν υπάρχει εξειδίκευση μόνο σε ένα στόχο και έτσι υπάρχουν παρενέργειες από την ανεπιθύμητη μείωση των πρωτεϊνών άλλων γονιδίων.
Ο λόγος της δράσης τους σε πολλά διαφορετικά γονίδια (ίσως και σε 100ντάδες γονίδια) είναι ότι αυτά ενώνονται με το mRNA τους, μόνο με 6-8 βάσεις από τις 21-23 που έχουν.
Γίνεται προσπάθεια να αναπτυχθούν φάρμακα που να αυξάνουν ή να μειώνουν τη δράση κάποιου miRNA.
Παραδείγματα δράσης των miRNAs: Η πρωτεΐνη p53 είναι βασική στην πρόληψη του καρκίνου. Ορισμένα miRNAs μειώνουν τη δράση της (π.χ. MiR-125b, miR-141) ευνοώντας τη δημιουργία καρκίνου και άλλα την αυξάνουν (π.χ. miR-34a) εμποδίζοντας τη δημιουργία καρκίνου.
Η επεξεργασία του DNA από το CRISPR-Cas9
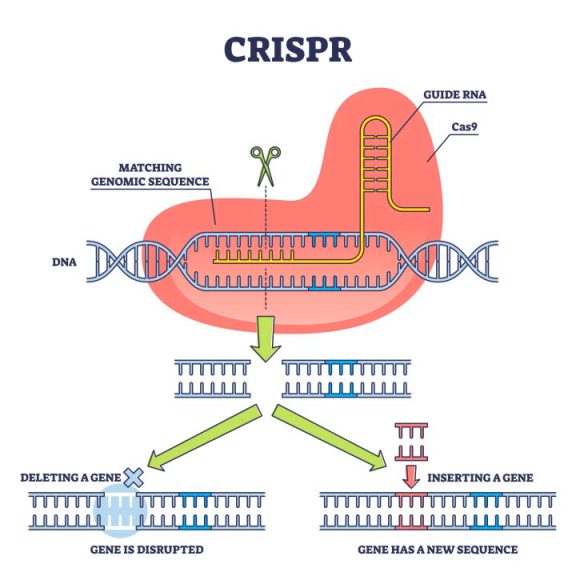
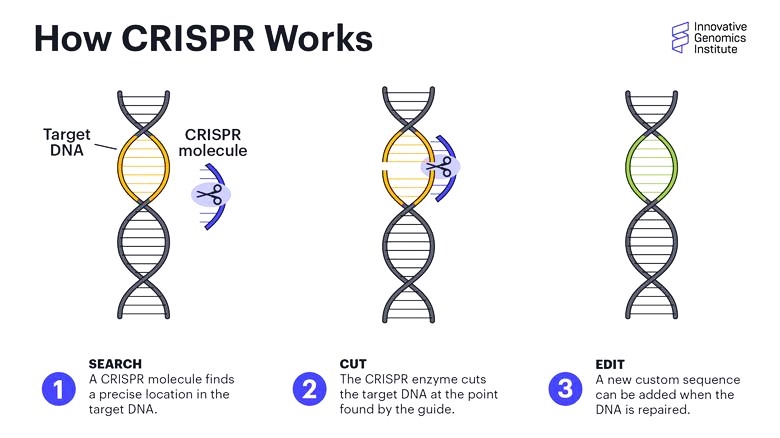
>> Το CRISPR-Cas9 (Clustered Regularly Interspaced Palindromic Repeats) είναι ένα νέο “εργαλείο” γενετικής μηχανικής για επεξεργασία του DNA μας, κυρίως για τη διόρθωση γονιδιακών μεταλλάξεων σε γονιδιακές παθήσεις αλλά μπορεί να χρησιμοποιηθεί και σε καρκίνους ή Σ.Διαβήτη τύπου 1 ή κατά ιώσεων κλπ.
Η ιδέα βασίζεται σε παρεμφερές αντι-ιικό αμυντικό σύστημα των μικροβίων.
Με τη χρησιμοποίηση συνθετικού οδηγού RNA μονής έλικας (sg RNA), που είναι συμπληρωματικό σε ένα γονίδιο, καθοδηγείται το ένζυμο νουκλεάση Cas9 σ’ αυτό το γονίδιο το οποίο και τροποποιεί με κόψιμο της διπλής έλικας του και είτε αφαιρεί γονίδιο είτε διορθώνει (αφαιρεί και προσθέτει) γονίδιο είτε προσθέτει γονίδιο που λείπει.
Επίσης αυτό μπορεί να σχεδιαστεί να δρα για ενεργοποίηση ή απενεργοποίηση γονιδίου (επιγενετικά), χωρίς να μεταβάλλεται το DNA.
Για την εισαγωγή στα κύτταρα του CRISPR-Cas9 χρησιμοποιείται συνήθως κάποιος ιός.
Πρόσφατα έχουν εγκριθεί:
>> Το Delandistrogene moxeparvovec (Elevidys), για τη θεραπεία της Μυϊκής Δυστροφίας Duchenne σε παιδιά 4-5 ετών που έχουν μετάλλαξη στο γονίδιο της πρωτεΐνης Δυστροφίνης.
>> Το Beremagene geperpavec (Vyjuvek), για τη θεραπεία πληγών σε ανθρώπους με Δυστροφική Πομφολυγώδη Επιδερμόλυση για χορήγηση φυσιολογικού γονιδίου COL7A1 του κολλαγόνου σε όσους έχουν μετάλλαξη σ’ αυτό.
>> Το Valoctocogene roxaparvovec (Roctavian), το οποίο εισάγει το γονίδιο του παράγοντα της πήξεως VIII, που απουσιάζει σε ανθρώπους με συγγενή έλλειψη του παράγοντα της πήξεως VIII (αιμορροφιλία Α)
>> Το CRISPR-Cas9 έχει χρησιμοποιηθεί επιπλέον σε μια ασθενή για αλλαγή βάσεως, χωρίς κόψιμο της διπλής έλικας του DNA, π.χ. δημιουργήθηκαν αλλογενή CAR–T κύτταρα για τη θεραπεία Οξείας Λεμφοβλαστικής Λευχαιμίας.
https://www.mdpi.com/1422-0067/24/15/12317
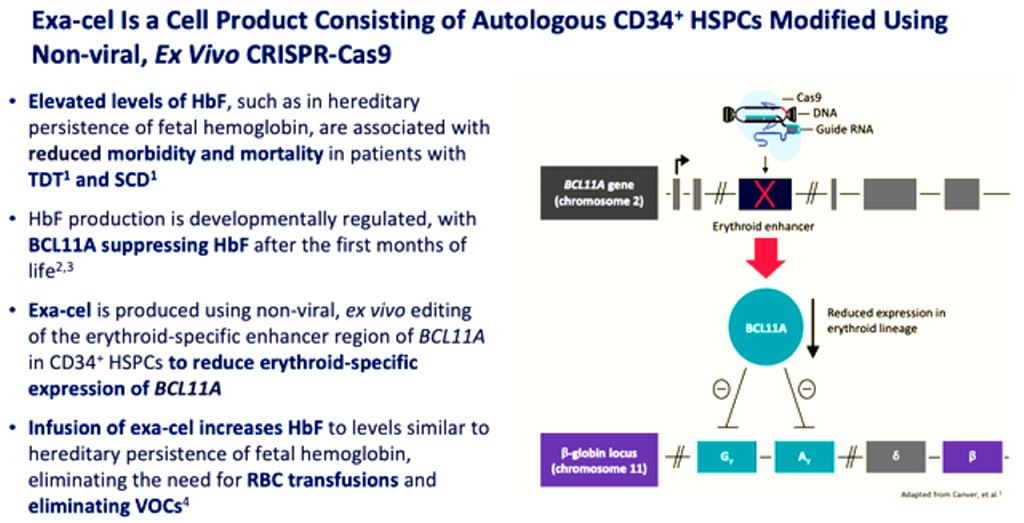
>> Έχει εγκριθεί το φάρμακο Exagamglogene autotemcel (Exa–cel, Casgevy) που έχει δείξει ενθαρρυντικά αποτελέσματα στη δρεπανοκυτταρική αναιμία και τη β Μεσογειακή αναιμία (ή β Θαλασσαιμία) που χρειάζεται μεταγγίσεις.
Αυτό αυξάνει την παραγωγή της εμβρυικής αιμοσφαιρίνης (HbF) που φυσιολογικά μειώνεται στους πρώτους μήνες της ζωής. [Το επιτυγχάνει μειώνοντας το γονίδιο BCL11A που εμποδίζει την έκφραση του γονιδίου της εμβρυικής αιμοσφαιρίνης]
>> Επίσης έχει εγκριθεί το φάρμακο lovotibeglogene autotemcel (Lyfgenia) για τη δρεπανοκυτταρική αναιμία, ώστε να παράγεται η Αιμοσφαιρίνη HbA T87Q, που δρα σαν την φυσιολογική Αιμοσφαιρίνη HbA.
>> Επιπλέον αναμένεται η έγκριση του φαρμάκου Fidanacogene elaparvovec, το οποίο εισάγει το γονίδιο του παράγοντα της πήξεως ΙΧ, σε ανθρώπους με αιμορροφιλία Β.
>> Για τη θεραπεία του Σ. Διαβήτη τύπου 1 υπάρχουν ενθαρρυντικά αποτελέσματα στη μελέτη VCTX210 με τη χρήση βλαστοκυττάρων που τροποποιήθηκαν να παράγουν ινσουλίνη και ταυτόχρονα να μην καταστρέφονται από το ανοσοποιητικό σύστημα.
[Στον Σ. Διαβήτη τύπου 1 τα κύτταρα του παγκρέατος που παράγουν ινσουλίνη έχουν καταστραφεί από το ανοσοποιητικό σύστημα (αυτοάνοση πάθηση)]
[Υπ’ όψιν ότι έχει εγκριθεί πρόσφατα η πρώτη κυτταρική θεραπεία με το Lantidra που είναι η χορήγηση αλλογενών β κυττάρων του παγκρέατος για τον Σ. Διαβήτη τύπου 1]
>> Επίσης δοκιμάζονται θεραπείες κατά ιών (π.χ. τον HIV) που θα εξοντώνουν τον ιό με μια μόνο χορήγηση (όπως τα μικρόβια εξοντώνουν τους ιούς).
>> Επιπλέον η εταιρία Intellia δοκιμάζει φάρμακα CRISPR-Cas9 για την ATTR αμυλοείδωση και το κληρονομικό αγγειοίδημα.
ΛΙΓΑ ΓΙΑ ΤΟ DNA και το RNA
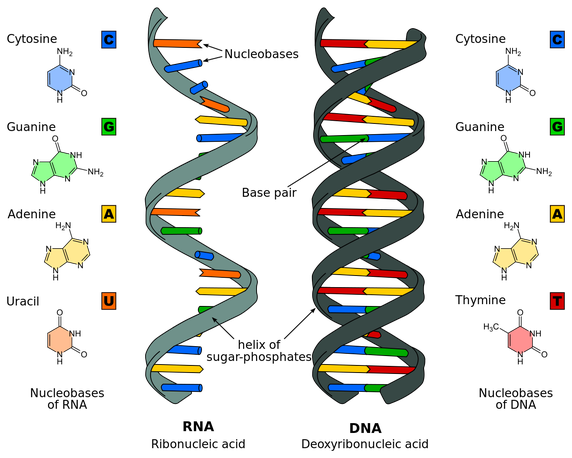
Το DNA (δεοξυριβονουκλεϊκό οξύ) απαντάται σε όλες τις μορφές ζωής (εκτός μερικών ιών) και βρίσκεται στον πυρήνα των κυττάρων, στα 23 ζεύγη χρωματοσωμάτων. Αυτό αποτελείται από ένα μακρομόριο διπλής έλικας με διαδοχικά νουκλεοτίδια που τα απαρτίζουν βάσεις σε σειρά.
Οι οδηγίες για τη κατασκευή και λειτουργία του σώματος περιέχονται στα γονίδια που υπάρχουν στο DNA, που περιέχει τον γενετικό μας κώδικα ή ανθρώπινο γονιδίωμα.
Η ζωή βασίζεται στο DNA, τόσο για την παραγωγή πρωτεϊνών που εκτελούν τις λειτουργίες των κυττάρων και του σώματος, όσο και για την αντικατάσταση των φθαρμένων κυττάρων, με νέα ακριβώς ίδια με τα αρχικά (μίτωση).
Έτσι το DNA μας, περιέχει τις πληροφορίες που χρειάζονται για την ανάπτυξη μας, την επιβίωση μας και την δημιουργία απογόνων.
Κάθε γονίδιο, που μεταφέρει την κληρονομική πληροφορία για την κατασκευή και λειτουργία μας έχει από 100δες ως πάνω από 1.000.000 διαδοχικά νουκλεοτίδια – βάσεις.
Συνολικά το ανθρώπινο DNA έχει 20.000 ως 25.000 γονίδια. Το ανθρώπινο γονιδίωμα έχει περίπου 3.2 δισεκατομμύρια ζεύγη νουκλοτιδικών βάσεων.
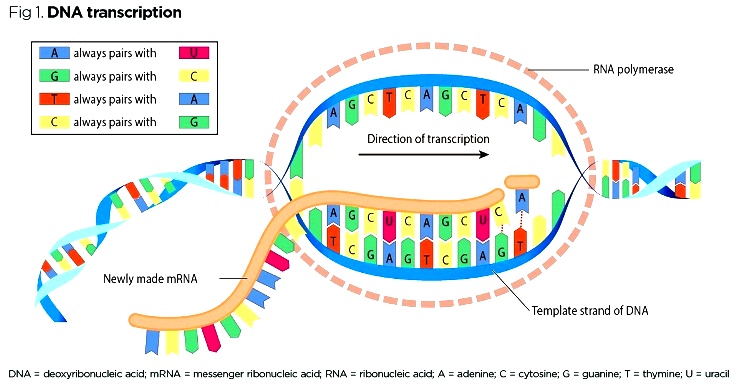
Οι βάσεις είναι 4, οι πουρίνες Αdenine-Α και Guanine-G και οι πυριμιδίνες Thymine-T και Cytosine-C. Οι ενώσεις μεταξύ των απέναντι βάσεων των δυο ελίκων του DNA είναι πάντα G με C και A με T.
(Το mRNA αντί για Τ έχει U, οπότε η Α ενώνεται με U)
Όλες οι πληροφορίες για τη δημιουργία και τη λειτουργία του σώματος υπάρχουν στους αμέτρητους συνδυασμούς των 4 βάσεων.
Κάθε γονίδιο έχει την αλληλουχία των διαδοχικών νουκλεοτιδίων-βάσεων που χρειάζονται για την κατασκευή και συνένωση των διαδοχικών αμινοξέων που απαρτίζουν μια ειδική πρωτεΐνη.
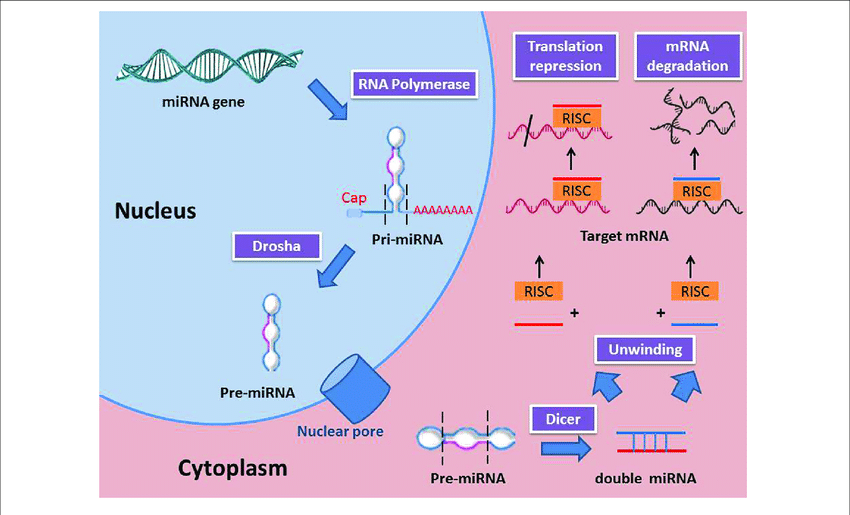
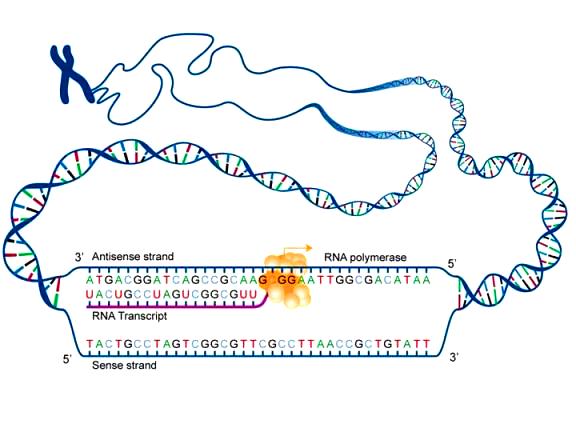
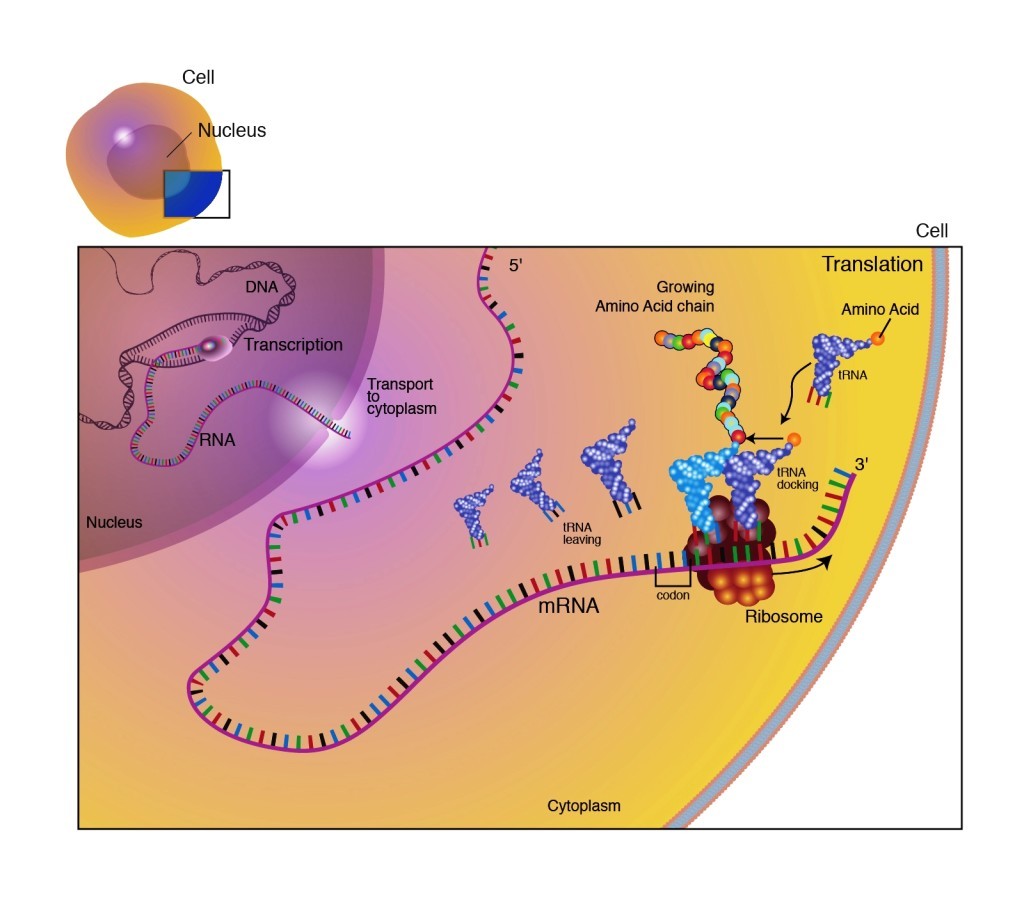
Γνωρίζουμε ότι η παραγωγή πρωτεϊνών στο ανθρώπινο σώμα ξεκινά από την αντιγραφή (transcription) του DNA σε mRNA και στη συνέχεια τη μετάφραση (translation) του mRNA σε Πρωτεΐνη.
Το mRNA [αγγελιοφόρο (messenger) RNA (RiboΝucleic Αcid – Ριβονουκλεϊκό οξύ)] μεταφέρει τη γενετική πληροφορία, σε μονή έλικα, αφού την αντιγράψει από το DNA του πυρήνα του κυττάρου, στα ριβοσώματα ώστε να παραχθούν τα αμινοξέα και στη συνέχεια οι πρωτεΐνες από αυτά.
Οι οδηγίες του DNA δημιουργούν την κάθε πρωτεΐνη μέσω δυο βημάτων:
α) Της αντιγραφής της μιας έλικας του DNA σε mRNA, στον πυρήνα του κυττάρου (transcription).
β) Της μετάφρασης του mRNA (στο κυτταρόπλασμα) σε αλυσίδα αμινοξέων (πρωτεΐνες), που συμβαίνει στα ριβοσώματα (translation).
ΕΝΔΕΙΚΤΙΚΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
https://www.nejm.org/doi/full/10.1056/NEJMoa2208391
https://www.ahajournals.org/doi/10.1161/JAHA.122.027694
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9957002/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4289821/
https://link.springer.com/article/10.1007/s40259-022-00549-3
https://www.nature.com/articles/s41392-020-0207-x
https://www.nature.com/articles/s12276-023-00998-y
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8946086/
https://synbio-tech.com/sirna-drugs/
https://www.biochempeg.com/article/339.html
Antisense Oligonucleotides Targeting Lipoprotein(a)
https://www.mdpi.com/1424-8247/15/5/575
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9285911/
https://www.frontiersin.org/articles/10.3389/fphar.2022.1006304/full
https://www.nature.com/articles/s12276-023-01050-9
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10129852/
https://www.jacc.org/doi/full/10.1016/j.jacc.2020.05.070
https://www.frontiersin.org/articles/10.3389/fbioe.2023.1208547/full
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10129852/
https://www.biochempeg.com/article/339.html
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9966809/
https://innovativegenomics.org/news/crispr-clinical-trials-2023/
https://www.chemistryworld.com/news/crispr-moves-into-the-clinic/4016694.article
https://www.sciencedirect.com/science/article/abs/pii/S1056872723001228?via%3Dihub
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016%2821%2900195-7
>> Πιο κάτω φαίνονται φάρμακα που εξελίσσονται κατά του mRNA (ASO και si RNA) για δράση σε άλλα όργανα, πέρα από το ήπαρ